§ 6. Формы существования химических элементов. Простые и сложные вещества. Вещества молекулярного и немолекулярного строения
 Какие вещества можно отнести к простым, а какие — к сложным?
Какие вещества можно отнести к простым, а какие — к сложным?
Химические элементы редко встречаются в природе в виде одиночных атомов. Например, в космическом пространстве существует в виде отдельных атомов водород. В условиях же Земли более естественной и распространённой формой существования химических элементов являются химические соединения — простые и сложные вещества.
Химические соединения, образованные атомами одного химического элемента, называют простыми веществами. Особую группу простых веществ- неметаллов составляют содержащиеся в воздухе инертные газы (Не, Ne, Аr, Кr), имеющие одноатомные молекулы. Их ещё называют благородные газы.
Химические соединения, образованные атомами разных химических элементов, называют сложными веществами.
Таким образом, можно выделить три формы существования химических элементов: в виде одиночных атомов; в составе простых веществ; в составе сложных веществ. В таблице 2 приведены примеры различных форм существования некоторых химических элементов в природе.
Простые вещества делятся на металлы и неметаллы. Классификация и общие характеристики физических свойств металлов и неметаллов представлены на рисунке 19.

Русские названия простых веществ обычно совпадают с русскими названиями соответствующих химических элементов: водород — водород, медь — медь и т. д. Но есть и исключения. Например, атомы элемента углерода образуют несколько простых веществ (аллотропных модификаций) — сажу, алмаз, графит, различных по строению и свойствам. Атомы элемента кислорода образуют два простых вещества: кислород и озон, обладающие разным составом молекул, а следовательно, и разными свойствами.
Таким образом, сходство в названиях элементов и простых веществ не должно приводить к отождествлению этих понятий (табл. 3).
Некоторые сведения о молекулярном и немолекулярном строении веществ
Как видно из рисунков таблицы 2, далеко не все химические соединения состоят из молекул. Атомы химических элементов, соединяясь друг с другом, в одних случаях образуют молекулы, в других — более сложные структуры.
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения.
Формы существования химических элементов в свободном виде
Формы существования химических элементов, одноатомные и многоатомные простые вещества
Простые вещества представляют собой формы существования химических элементов в свободном виде; каждому элементу соответствует, как правило, несколько простых веществ (аллотропных форм), которые могут различаться по составу, например атомный кислород O, кислород O2 и озон O3, или по кристаллической решётке, например алмаз и графит для элемента углерод C. Очевидно, что простые вещества могут быть одноатомными и многоатомными.
Сложные вещества иначе называются химическими соединениями. Этот термин означает, что вещества могут быть получены с помощью химических реакций соединения из простых веществ (химического синтеза) или разделены на элементы в свободном виде (простые вещества) с помощью химических реакций разложения (химического анализа).
Суммируя всё сказанное выше, можно записать:
Синтезу химический процесс
Понятия «синтез» и «анализ» химических веществ используются в более широком смысле. К синтезу относят любой химический процесс, который приводит к получению необходимого вещества и при этом существует возможность его выделения из реакционной смеси. Анализом считается любой химический процесс, позволяющий определить качественный и количественный состав вещества или смеси веществ, то есть установить, из каких элементов составлено данное вещество и каково содержание каждого элемента в этом веществе. Соответственно различают качественный и количественный анализ — две составные части одной из химических наук — аналитической химии.
Урок + презентация по химии для 8 класса по теме «Формы существования химических элементов. Простые и сложные вещества»
Ищем педагогов в команду «Инфоурок»
Выбранный для просмотра документ Презентация урока химии Антиповой Л.Н..pptx

Описание презентации по отдельным слайдам:
Задание для учащихся №1: Распределите на 3 группы предложенные вам шаростержневые модели Обоснуйте свои варианты классификации?
Задание для учащихся № 2: Исходя из вашей классификации сформулируйте тему урока и цель Тема урока: «Формы существования химических элементов. Простые и сложные вещества» Цель: Познакомиться с тремя формами существования химических элементов в природе и научиться различать простые и сложные вещества.
Задание для учащихся №3: 1.Рассмотрите таблицу 2 на стр. 27 вашего учебника и соотнесите ее со своей классификацией, составленной при работе с шаростержневыми моделями. 2.Предложите свою схему «Форм существования химических элементов»
схема «Формы существования химических элементов»
ВЫВОД 1: Атомы химических элементов существуют в свободном виде либо в составе простых и сложных веществ ЗАДАНИЕ: Прочитайте в учебнике вывод 1 на с.30 и запишите в тетрадь
Задание для учащихся № 4: Используя комплект карточек с формулами распределите их согласно схеме «Формы существования химических элементов» Работа в парах O2 Na O S NaOH H2SO4 H2O H2
Проверка выполнения задания № 4: O2 Na O S NaOH H2SO4 H2O H2
Рефлексивный момент: Поднимите руку, кто выполнил задание без ошибок, с одной ошибкой, с двумя ошибками Оцените каждый себя
Задание для учащихся №5: 1.Найдите в учебнике на с.27 и выпишите в тетрадь определения простого и сложного вещества 2. Проговорите в парах выписанные понятия 3. Двум ученикам озвучить вслух эти определения Работа в парах
Словарь химических понятий Химические соединения, образованные атомами одного химического элемента, называют простыми веществами Химические соединения, образованные атомами разных химических элементов, называют сложными веществами
Домашнее задание: §6, упр. №3 на с.30 Подготовить сообщение «Простые и сложные вещества вокруг нас» (по желанию)
Ответьте на вопросы: 1.Что нового узнали на уроке? 2.Чему научились? 3.С помощью чего удалось освоить новый материал? Заполните рефлексивную карту
Рефлексивная карта Вопросы Да Не совсем (есть ошибки) Нет 1.Научились ли вы различать простые и сложные вещества 2.Знаете ли вы признак, по которому различаются простые и сложные вещества 3.Можете ли вы объяснить, что такое простые и сложные вещества
СПАСИБО ЗА ПРОДУКТИВНУЮ РАБОТУ!
Выбранный для просмотра документ Раздаточный материал. Формулы.docx
Выбранный для просмотра документ Разработка урока химии Антиповой Л.Н..docx
МБОУ «Основная общеобразовательная школа №5 г. Лесосибирска», Красноярского края,
Предмет: химия 8 класс
Тема урока «Формы существования химических элементов. Простые и сложные вещества»
Тип урока: изучение нового материала, введение новых понятий
В вязи с переходом на новые стандарты меняется роль учителя, необходимы подходы к организации деятельности учащихся. Ученик становится равноправным субъектом процесса обучения и поэтому управленческая компетентность учителя становится ведущей в его деятельности. Для этого использую как средство технологическую карту с подробным описанием деятельности ученика и учителя. На каждом этапе урока в соответствии с его целью, учитель предлагает учащимся задания, включающие его в самостоятельную деятельность в результате для учащихся учебное занятие выстраивается в виде системы учебных заданий, выполнение которых позволяет не только усвоить учебный материал, но и развить такие компетентности как информационную, коммуникативную, организационную, применить такие методы как моделирование, схематизирование, работа с таблицами, определением. На таких уроках у учащихся повышается интерес к учебно-познавательной деятельности, усвоение учебного материала происходит на продуктивном уровне, повышается мотивация к учению и в целом повышается качество образовательного процесса.
Методическая разработка инновационного урока химии в 8 классе
по теме «Формы существования химических элементов. Простые и сложные вещества».
Цель: Познакомить учащихся с тремя формами существования химических элементов в природе и научить различать простые и сложные вещества.
Результат: Учащиеся узнают о трех формах существования химических элементов и научатся различать простые и сложные вещества.
Средство обучения: учебник химии 8 класс автор Н.Е.Кузнецова.
Оборудование: компьютер с презентацией урока, на каждой парте наборы шаростержневых моделей и карточки с формулами H 2 , H 2 O , H 2 SO 4 , NaOH , S , O , Na , O 2, для каждого ученика таблица с рефлексивной картой.
Технологическая карта урока:
Содержание деятельности учителя
Содержание деятельности ученика
Включение учащихся в активную интеллектуальную деятельность
На столах учащихся находятся комплекты шаростержневых моделей: атомов, простых и сложных веществ.
Учитель предлагает выполнить задание 1 : распределите на 3 группы предложенные вам модели.
Просит обосновать свои варианты классификации?
Распределяют модели по 3 группам, сравнивая их по внешним признакам и составу.
Предъявляют свои варианты, обосновывают.
Получили 3 группы моделей (классифицировали по признаку «состав»)
Вычленили главный признак классификации – состав.
2 этап. Самоопределение
Определить тему урока, сформулировать учебную задачу
Учитель предлагает выполнить задание 2: исходя из вашей классификации сформулируйте тему урока и цель
Учитель корректирует формулировку темы и предлагает записать ее в тетрадь (Демонстрация слайда с темой урока)
Формулируют и проговаривают тему урока и цель.
Записывают тему в тетрадь и формулируют учебную задачу
Сформулирована и записана тема урока.
Определена учебная задача
3 этап. Момент осознания учащимися недостающих знаний
Освоить понятие- «формы существования химических элементов»: одиночные атомы, простые вещества, сложные вещества
Учитель предлагает выполнить задание 3:
1.Рассмотрите таблицу 2 на стр. 27 вашего учебника и
соотнесите со своей классификацией, составленной при работе с шаростержневыми моделями.
2.Предложите свою схему «Форм существования химических элементов»
Слайд 6 (демонстрация слайда со схемой)
Учитель демонстрирует правильный вариант схемы «Формы существования химических элементов» и просит скорректировать свои записи в тетради
ЗАДАНИЕ: Прочитайте вывод 1 на с.30 и запишите его в тетрадь
Рассматривают таблицу 2 ( слайд 5 )
Соотносят со своей классификацией
Предлагают свою схему «Формы существования химических элементов»
Сверяют и корректируют схему в тетради
Читают и записывают вывод
Рассмотрели таблицу 2
Соотнесли со своей классификацией
Предложили свою схему «Формы существования химических элементов»
Составленная в тетради схема
4 этап. Закрепление нового материала
Учитель предлагает ученикам, работая в паре выполнить задание 4:
используя комплект карточек с
распределите их согласно схеме «Формы существования химических элементов»
Слайд 9 Проверка правильности выполнения задания
(демонстрация слайда с правильным распределением карточек с формулами).
Учитель проводит рефлексивный момент:
поднимите руку, кто выполнил задание
Учитель предлагает выполнить задание 5:
1.Найдите в учебнике на с.27 и выпишите в тетрадь определения простого и сложного вещества.
2. Проговорите в парах выписанные понятия
Учитель предлагает отельным учащимся озвучить определения вслух (демонстрируется слайд 12. Словарь химических терминов)
Учитель предлагает записать домашнее задание
1) §6, упр. №3 на с.30 и дает комментарии, 2) подготовить сообщение «Простые и сложные вещества вокруг нас» (по желанию)
Распределяют карточки на столе
Проверяют правильность выполнения
Находят и выписывают в тетрадь определения простого и сложного вещества.
Работают в паре, проговаривая определения
Записывают задания в дневник и слушают комментарии к выполнению задания
Оценили каждый себя
Сформировано понятие «Формы существования химических элементов»
Обогатили химическими терминами словарный запас.
Записали задания в дневник, получили комментарии
Осознание учениками и воспроизведение в речи того что узнали и чему научились
Учитель предлагает ответить на вопросы:
1.Что нового узнали на уроке?
3.С помощью чего удалось освоить новый материал?
Учитель предлагает заполнить каждому ученику рефлексивную карту.
(смотрите в приложении) и сдать учителю.
Выявляет уровень усвоения учебного материала по заполненным учениками рефлексивным картам и подводит итог уровня усвоения учебного материала
Отвечают на вопросы
Заполняют рефлексивную карту и сдают ее учителю
Все усвоили новые понятия
Выявили уровень усвоения учебного материала и определили эффективность урока
Выбранный для просмотра документ Рефлексивная карта.docx
1.Научились ли вы различать простые и сложные вещества
2.Знаете ли вы признак, по которому различаются простые и сложные вещества
3.Можете ли вы объяснить, что такое простые и сложные вещества
1.Научились ли вы различать простые и сложные вещества
2.Знаете ли вы признак, по которому различаются простые и сложные вещества
3.Можете ли вы объяснить, что такое простые и сложные вещества
1.Научились ли вы различать простые и сложные вещества
2.Знаете ли вы признак, по которому различаются простые и сложные вещества
3.Можете ли вы объяснить, что такое простые и сложные вещества
1.Научились ли вы различать простые и сложные вещества
2.Знаете ли вы признак, по которому различаются простые и сложные вещества
3.Можете ли вы объяснить, что такое простые и сложные вещества
1.Научились ли вы различать простые и сложные вещества
2.Знаете ли вы признак, по которому различаются простые и сложные вещества
3.Можете ли вы объяснить, что такое простые и сложные вещества

Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Современные педтехнологии в деятельности учителя

Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС

Представленный материал содержит конспект и презентацию урока по теме «Формы существования химических элементов. Простые и сложные вещества» для учащихся 8 класса.
Мной составлена технологическая карта с подробным описанием деятельности ученика и учителя. На каждом этапе урока в соответствии с его целью, учитель предлагает учащимся задания, включающие его в самостоятельную деятельность в результате для учащихся учебное занятие выстраивается в виде системы учебных заданий, выполнение которых позволяет не только усвоить учебный материал, но и развить такие компетентности как информационную, коммуникативную, организационную, применить такие методы как моделирование, схематизирование, работа с таблицами, определением.

В результате на данном уроке у учащихся повышается интерес к учебно-познавательной деятельности, усвоение учебного материала происходит на продуктивном уровне, повышается мотивация к учению.
Предмет: химия 8 класс
Тема урока «Формы существования химических элементов. Простые и сложные вещества»
Тип урока: изучение нового материала, введение новых понятий
Пояснительная записка.
В вязи с переходом на новые стандарты меняется роль учителя, необходимы подходы к организации деятельности учащихся. Ученик становится равноправным субъектом процесса обучения и поэтому управленческая компетентность учителя становится ведущей в его деятельности.
Для этого использую как средство технологическую карту с подробным описанием деятельности ученика и учителя. На каждом этапе урока в соответствии с его целью, учитель предлагает учащимся задания, включающие его в самостоятельную деятельность в результате для учащихся учебное занятие выстраивается в виде системы учебных заданий, выполнение которых позволяет не только усвоить учебный материал, но и развить такие компетентности как информационную, коммуникативную, организационную, применить такие методы как моделирование, схематизирование, работа с таблицами, определением.
На таких уроках у учащихся повышается интерес к учебно-познавательной деятельности, усвоение учебного материала происходит на продуктивном уровне, повышается мотивация к учению и в целом повышается качество образовательного процесса.
Методическая разработка инновационного урока химии в 8 классепо теме «Формы существования химических элементов. Простые и сложные вещества».
Цель: Познакомить учащихся с тремя формами существования химических элементов в природе и научить различать простые и сложные вещества.
Результат: Учащиеся узнают о трех формах существования химических элементов и научатся различать простые и сложные вещества.
Средство обучения: учебник химии 8 класс автор Н.Е.Кузнецова.
Оборудование: компьютер с презентацией урока, на каждой парте наборы шаростержневых моделей и карточки с формулами H2, H2O, H2SO4, NaOH, S, O, Na, O2, для каждого ученика таблица с рефлексивной картой.
Урок№9. Простые и сложные вещества.
ОТЛИЧИТЕЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СООТВЕТСТВУЮЩИХ ПРОСТЫХ ВЕЩЕСТВ
1. Твёрдое агрегатное состояние (исключение – ртуть)
2. Металлический блеск
3. Хорошие проводники тепла и электричества.
4. Пластичные и ковкие.
2. Металлическим блеском не обладают (исключение йод)
3. Не проводят тепло и электрический ток – ИЗОЛЯТОРЫ.
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия “химический элемент”, “атом” и “простое вещество”
Простые и сложные вещества
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Их условно классифицировали на металлы и неметаллы
На 2019 год в периодической таблице – 118 химических элементов, которые образуют около 500 простых веществ.
Итак, подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Простыми называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие понятий «смесь» и «химическое соединение»
Сложные вещества часто называют химическими соединениями.
Попробуйте ответить на вопросы:
1.Чем отличаются по составу смеси от химических соединений?
2. Сопоставьте свойства смесей и химических соединений?
3. Какими способами можно разделить на составляющие компоненты смеси и химического соединения?
4. Можно ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная характеристика смесей и химических
Формы существования химических элементов. Современное представление о строении атома. Изотопы



ХИМИЧЕСКИЙ ЭЛЕМЕНТ
Ярослав в Киеве.
1017 г. и 1036 г. – блестящие победы Ярослава над печенегами.
1031 г. – в пограничном с печенегами Поросье селит военнопленных поляков.
1032 г. – строится система поросских сторожевых башен.
Оборонительные линии – для защиты от набегов степняков (печенегов, потом половцев) строились целые защитные системы, включавшие в себя военно-феодальные замки, сигнальные башни, земляные валы и рвы. При этом было бы неверно считать, что первые попытки отгородиться от степи возникают, только в XI в. Земляные валы стали строиться задолго до появления Киевской Руси, централизация государства только ускорили этот процесс. Валы, как правило, сопровождались рвом, но не имели дополнительных деревянных укреплений (частоколов).
[1] Сахаров А.Н. Дипломатия Древней Руси.
[2] Ч.с.х. Свенельд оставил Святослава во время возвращения в Киев из Византии, когда князь и был убит. Свенельд отправился в Киев другим путём вместе с варягами.
[3] Судя по договорам с греками на момент крещения была два официальных культа – Перуна и Велеса. То что Перуну собрали команду из супергероев, а Велеса туда даже не позвали, указывает на радикальный характер реформы.
Атомно-молекулярное учение (основные понятия и законы химии)
Атомно-молекулярное учение развил и впервые применил к химии М. В. Ломоносов. Основные положения этого учения изложены в его работе «Элементы математической химии» (1741 г.) и др. Сущность учения Ломоносова заключается в следующем: 1. Все вещества состоят из молекул (корпускул). 2. Молекулы состоят из атомов (элементов). 3. Частицы (молекулы, атомы) находятся в непрерывном движении. Тепловое состояние тел есть результат движения этих частиц. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ – из различных атомов.
Через 67 лет после Ломоносова, в 1808 г., атомистическое учение в химии применил английский ученый Джон Дальтон в книге «Новая система химической философии». В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, т. к. Дальтон впервые попытался установить атомные массы известных тогда элементов. Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX в., когда в 1860 г. на международном съезде химиков в г. Карсруэ (Швеция) были приняты определения понятий молекулы и атома.
По современным представлениям, атом– это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Неправильно говорить, что «атом – наименьшая частица химического элемента, сохраняющая все его химические свойства», т. к. химический элемент– это вид частиц (атомов, ионов, ядер) с определенным зарядом ядра; поэтому элемент не состоит из атомов! Кроме того, химические свойства – это энергетика и скорость химической реакции, а они зависят не только от состава реагирующей частицы, но и от ее энергетического состояния, геометрической формы и т. п., потому химическими свойствами обладают не атомы (и молекулы), а их совокупности – химические вещества.
Молекула – это электронейтральная наименьшая совокупность атомов, образующих определенную структуру посредством химических связей, определяющая состав вещества.
Закон постоянства состава вещества. Этот закон впервые сформулировал французский ученый химик Жозеф Луи Пруст в 1808 г.: Всякое чистое вещество независимо от способа его получения имеет постоянный качественный и количественный состав.
Пример: вещество вода может быть получено, например, следующими способами:
Границы применения закона:
1. Постоянен лишь атомный состав вещества. Это объясняется существованием изотопов– ядер атомов, содержащих одинаковое число протонов, но разное число нейтронов, и поэтому имеющих разную массу.
Пример: 1). Если в молекуле воды содержится атом изотопа водорода протия 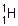 , то соотношение масс m (H) : m (O) = 1 : 8. 2). Если в молекуле воды содержится атом изотопа водорода дейтерия
, то соотношение масс m (H) : m (O) = 1 : 8. 2). Если в молекуле воды содержится атом изотопа водорода дейтерия  (D), то соотношение масс m (H) : m (O) = 1 : 4. 3). Если в молекуле воды содержится атом изотопа водорода трития
(D), то соотношение масс m (H) : m (O) = 1 : 4. 3). Если в молекуле воды содержится атом изотопа водорода трития 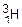 (Т), то соотношение масс m (H) : m (O) = 3 : 8. Однако, в каждом из этих случаев соотношение числа атомов водорода и кислорода одно и то же – 2 : 1.
(Т), то соотношение масс m (H) : m (O) = 3 : 8. Однако, в каждом из этих случаев соотношение числа атомов водорода и кислорода одно и то же – 2 : 1.

2. Закону постоянства состава подчиняются лишь вещества с молекулярной структурой (дальтониды). Вещества с атомной (например, карбид кремния SiC), металлической (например, тантал-диванадий V2Ta), ионной (например, сульфид железа (II) FeS) кристаллическими решетками не подчиняются этому закону (бертоллиды).
Закон постоянства состава вещества позволяет писать химические формулы.
Относительная атомная (Аr) и относительная молекулярная (Мr) массы – это числа, показывающие, во сколько раз масса атома или молекулы больше 1/12 массы атома изотопа углерода 12 С.
Относительные атомная и молекулярная массы – безразмерные величины. Абсолютные массы атомов и молекул очень малы, поэтому в качестве единицы измерения используют не килограмм или грамм, а атомную единицу массы (а. е. м.), которая равна 1/12 m( 12 С) = 1,66057×10 –24 кг. Т. о. Аr(Аl) = 27 – это относительная атомная масса алюминия, а mo(Al) = 27 а. е. м. – абсолютная масса атома алюминия.
Моль – это количество вещества, содержащее столько же структурных единиц (атомов, ионов, ядер, электронов, радикалов и т. п.), сколько содержится атомов в 12 г углерода 12 C.
В одном моле любого вещества содержится число Авогадроструктурных единиц, а именно: NA = 6,02×10 23 структурных единиц.
Молярная (мольная) массаМ – это масса 1 моль вещества, выраженная в единицах массы. Например, M(Al) = 27 г/моль; M(H2SO4) = 98 г/моль.
Молярный (мольный) объем Vm – объем 1 моль вещества, выраженный в единицах объема. Например, Vm(CO2) = 22,4 л/моль (н. у.: Т = 273,15 К, p = 101325 Па); Vm(H2O) = 18 мл/моль.
Закон Авогадро: В равных объемах различных газов при одинаковых условиях (Т, р) содержится равное число молекул.
Следствия из закона Авогадро:
1. При одинаковых условиях 1 моль любого газа занимает одинаковый объем. При н. у. Vm (газа) = 22,4 л/моль.
2. Молярная масса вещества в газообразном состоянии равна его удвоенной плотности по водороду.
Относительная плотность газа – это число, показывающее, во сколько раз один газ тяжелее другого.
Химический элемент – вид атомов, ионов, ядер с определенным зарядом ядра.
Основными характеристиками химического элемента являются: заряд ядра, относительная атомная масса, распространенность.
Простое вещество –это химический элемент в свободном виде.
Сложное вещество (химическое соединение) – это химически индивидуальное вещество, состоящее из атомов различных элементов, химически связанных между собой.
Современные представления о строении атома
Атом представляет собой сложную систему находящихся в движении и взаимодействии элементарных частиц. Экспериментально установлено, что каждый атом состоит из 2-х областей, несущих противоположные заряды. Заряд области, где сосредоточена почти вся масса атома, условно принято считать положительным. Эта область названа ядром атома. На некотором расстоянии от ядра располагаются области с отрицательным зарядом – электронные орбитали, т. е. области определенной вероятности нахождения электрона.
Носителями положительного заряда ядер являются протоны. За исключением ядра атома водорода, согласно протонно-нейтронной теории (Дмитрий Дмитриевич Иваненко, Россия, Вернер Гейзенберг, Германия, 1932 г.), ядра содержат также и нейтроны. Протон и нейтрон – два состояния ядерной частицы нуклона:
| Элементарная частица | Заряд, относительные единицы (в скобках указаны абсолютные заряды в Кл). | Масса, относительные единицы (в скобках указаны абсолютные массы в кг) |
| Протон р | +1 (1,602×10 –19 ) | 1,007276 (1,6726×10 –27 ) |
| Нейтрон n | 0 | 1,008665 (1,67495×10 –27 ) |
| Электрон е | –1 (1,602×10 –19 ) | 5,485799×10 –4 (9,1094×10 –31 ) |
Общее число нуклонов в ядре равно относительной атомной массе.
Число протонов в ядре равно заряду ядра Z, выраженному в единицах заряда электрона (относительных единицах). Число нейтронов N равно разнице (Ar–Z). Число электронов в атоме равно числу протонов (заряду ядра).
Задания для самостоятельной работы
1.1. Из молекул, а не из атомов и ионов, состоит:
1) сухой лед; 2) алмаз; 3) латунь; 4) поташ.
1.2. Трехэлементное вещество – это:
1) бертолетова соль; 2) оксид азота (III); 3) питьевая сода; 4) ацетат натрия.
1.3. Веществами молекулярного строения являются все вещества ряда:
1) сера, поваренная соль, сахар; 2) поваренная соль, сахар, глицин;
3) сахар, глицин, медный купорос; 4) сера, сахар, глицерин.
1.4. Атом изотопа калия 40 К содержит ___ протонов. Ответ запишите цифрами.
1.5. Химический элемент, один из изотопов которого имеет массовое число 44 и содержит в ядре 24 нейтрона, – это:
1) хром; 2) кальций; 3) рутений; 4) скандий.
1.6. Массовое число изотопа равно:
1) массе протонов и электронов в атоме; 3) массе всех составляющих его частиц;
2) числу протонов и нейтронов в его ядре; 4) числу всех частиц в его составе.



