Неотложные состояния при болезни Паркинсона
Болезнь Паркинсона (БП) – хроническое прогрессирующее заболевание головного мозга, преимущественно связанное с дегенерацией дофаминергических нейронов черной субстанции с накоплением в них белка α-синуклеина и образованием особых внутриклеточных включений (телец Леви), которое проявляется сочетанием гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью, а также широким спектром немоторных проявлений (психических, вегетативных, сенсорных и др.) [1, 2].
Хроническое медленно прогрессирующее течение процесса при этом заболевании может меняться с развитием острой декомпенсации БП – внезапного нарастания симптомов паркинсонизма, сопровождающегося
существенным ограничением функциональных возможностей пациента и сохраняющегося более 24 часов, несмотря на продолжение или возобновление привычной для пациента противопаркинсонической терапии [3]. Данное расстройство развивается у 0,3-1% больных БП ежегодно, а в 10% случаев приводит к летальному исходу.
— акинетический криз (АК);
— акинетико-гипертермический (злокачественный) синдром (АГС);
— злокачественный нейролептический синдром (ЗНС);
— тяжелые инвалидизирующие дискинезии с гипертермией;
— психоз;
— серотониновый синдром (СС).
Неотложные состояния при БП, в зависимости от состояния и степени вовлеченности дофаминергической системы, условно можно разделить на две группы:
1. Неотложные состояния, возникающие в результате дофаминергического дисбаланса:
А – развивающиеся в период «OFF» или гипофункции дофаминергической системы: синдром паркинсонизм – гиперпирексия или акинетический криз;
Б – развивающиеся в период «ON» или избыточной активности дофаминергической системы: психоз, тяжелая дискинезия с гиперпирексией и т.п.;
2. Неотложные состояния, не связанные напрямую с состоянием дофаминергической системы (серотониновый синдром, электролитные нарушения и т.п.)
Акинетический криз и акинетико-гипертермический (злокачественный) синдром
Акинетический криз – резкое нарастание гипокинезии и ригидности с развитием обездвиженности, спутанности сознания, анартрии, нарушения глотания и вегетативными расстройствами (тахикардия, артериальная
гипотензия, недержание мочи, потоотделение). Для акинетико-гипертермического синдрома характерны симптомы акинетического криза, а также гипертермия (гиперпирексия), вызванная дисфункцией гипоталамуса.
К основным причинам развития АК и АГС относятся:
— изменение дофаминергической терапии;
— блокада дофаминергических рецепторов;
— интеркуррентные состояния;
— нарушение работы системы глубокой электростимуляции (при наличии таковой у пациента).
Точная частота развития АК и АГС не известна. Наиболее цитируемой работой, в которой обсуждается частота встречаемости данных расстройств, является статья M.Serrano-Duenas [4]. Согласно его данным, у 3,6% (11 пациентов из 305) регулярно наблюдаемых им пациентов с БП в течение 9 лет развилось данное расстройство. Среди всех осмотренных за 9 лет пациентов с БП данный процент составил 0,04%. Во всех случаях причиной развития АГС являлась самостоятельная отмена препаратов леводопы без согласования с лечащим врачом. С другой стороны, в исследовании ELLDOPA [5], в которое были включены пациенты с ранней стадией заболевания, в результате двухнедельной отмены леводопы ни у одного из 361 пациента не развился АГС. Данный факт указывает на значение выраженности дегенерации нигростриатного пути, отражающего стадию заболевания в развитииакинетического криза.
Патофизиология акинетического криза окончательно не ясна, однако очевидно, что в основе его развития лежит не только отмена препарата. Особенностью АК является низкая эффективность возобновленной терапии
леводопой, при этом срок начала ответа может достигать 11 дней. Таким образом, во время акинетического криза, по-видимому, развивается временная блокировка ответа на привычную для пациента терапию. В 2014 г. была опубликована работа [6], в которой при помощи SPECT с лигандом [123I] FP-CIT, проведенной до, в период и после акинетического криза, было показано, что в острый период происходит значимое снижение накопления лиганда в пресинаптических терминалях стриатума и его дальнейшее медленное восстановление.
Впервые АГС был описан в 80-е годы ХХ в. у пациентов во время прекращения дофаминергической терапии в рамках проведения «лекарственных каникул». В настоящее время, в связи с пониманием всей опасности «лекарственных каникул», наиболее частой причиной развития АК и АГС называют изменение схемы ранее назначенной терапии (резкое снижение дозы, непропорциональная замена дофаминергического препарата). Прием препаратов, блокирующих дофаминовые рецепторы, таких как типичные нейролептики, метоклопромид, циннаризин, резерпин и др., также может приводить к развитию декомпенсации БП. Более того, существуют сообщения о развитии АК на фоне приема препаратов из группы атипичных нейролептиков. Нельзя забывать и о возможности влияния интеркуррентных заболеваний на течение БП. АГС может развиваться у пациентов с патологией желудочно-кишечного тракта в связи со снижением всасывания дофаминергических препаратов и развития состояния, эквивалентного отмене терапии. К таким состояниям относятся опухоли, резекция кишечника, тяжелые гастроэнтериты, непроходимость. Некоторые сопутствующие заболевания, несмотря на отсутствие прямого влияния на всасывание препаратов, также способны приводить к АК/АГС (инфекции, дегидратация, электролитные расстройства). Основными электролитными расстройствами, способными привести к развитию острой декомпенсации, являются гипо- и даже гипернатриемия, а неадекватная коррекция данных состояний способна вызвать понтинный или экстрапонтинный миелинолиз, усугубив течение АГС. Описаны случаи развития декомпенсации, связанные с менструальным циклом – вероятно за счет отрицательного влияния высокого уровня прогестерона на дофаминергическую систему. В связи с активным внедрением глубокой электростимуляции головного мозга, нельзя забывать о возможности развития декомпенсации у пациентов, перенесших данное оперативное лечение. Акинетический криз может развиться в случае прекращения стимуляции, некорректного программирования стимулятора, разрядки батареи, и даже непреднамеренного отключения стимуляции самим пациентом. При этом описаны случаи развития АГС в результате снижения дозы дофаминергической терапии даже на фоне эффективной глубокой электростимуляции.
Акинетический криз и акинетико-гипертермический синдром – неотложные состояния, требующие срочной госпитализации пациента в отделение интенсивной терапии. При развитии данной патологии в кратчайшие сроки должна быть проведена диагностика возможных интеркуррентных заболеваний (в первую очередь инфекционных), проведен комплекс лабораторных обследований (в первую очередь для исключения водно-электролитного и кислотно-щелочного расстройства). Акинетический криз требует тесного взаимодействия реаниматолога и невролога.
Клиническая картина АГС характеризуется следующими симптомами:
— сроки развития от 18 часов до 7 суток (с момента изменения/прекращения дофаминергической терапии или развития состояния, которое могло спровоцировать декомпенсацию);
— выраженная ригидность/акинезия;
— вегетативные расстройства (тахикардия, тахипноэ, лабильность АД, нарушение мочеиспускания, цианоз, потоотделение);
— через 72-96 часов (в некоторых случаях одновременно с дебютом акинезии) развивается гипертермия (до 41 °С);
— нарушение сознания (от возбуждения до оглушения и комы);
— возможно развитие генерализованных тонико-клонических судорог, миоклоний;
— изменение лабораторных показателей: лейкоцитоз, повышение уровня креатинкиназы (260-50000 Ед/л);
Основными осложнениями АК и АГС являются:
— тромбоз глубоких вен;
— эмболия легочной артерии;
— аспирационная пневмония;
— почечная недостаточность.
Мероприятия, проведение которых необходимо при поступлении больного с акинетическим кризом:
— интубация, проведение ИВЛ (при выраженной дыхательной недостаточности);
— постановка назогастрального зонда, мочевого катетера;
— антибиотикотерапия (в случае выявления инфекционного процесса);
— назначение антипиретиков;
— адекватная инфузионная терапия (коррекция электролитных расстройств);
— гемодиализ (при выявлении почечной недостаточности);
— гепаринотерапия, компрессионный трикотаж (профилактика тромбоза глубоких вен голеней и эмболии легочной артерии);
— позиционирование в кровати (профилактика пролежней).
Основой терапии акинетического криза является восстановление приема дофаминергической терапии в случае ее отмены. Особенности ответа на возобновленную терапию требуют учета следующих аспектов:
— раннее возобновление дофаминергической терапии;
— увеличение исходной дозы дофаминергических препаратов;
— продолжение терапии вне зависимости от наличия ответа (должный ответ может развиться лишь спустя 11 суток);
— невозможность ограничения терапии акинетического криза только дофаминергическими препаратами.
Важным дополнением к терапии является введение раствора амантадина сульфата как препарата, способного снизить активность глутаматной системы, возможно лежащей в основе АГС. Следует придерживаться следующей схемы назначения препарата:
— 500 мл раствора (200 мг амантадина сульфата) 2-3 раза в день в течение 10-14 дней;
— после завершения курса инфузионной терапии обязателен перевод на пероральную форму в таблетках (300-600 мг/сут).
Также в качестве дополнительной терапии рассматриваются апоморфин, дантролен и метилпреднизолон. К сожалению, первые два препарата не зарегистрированы в нашей стране. Метилпреднизолон назначается в дозе 1000 мг/сут в течение 3-5 дней. Терапия метилпреднизолоном существенно улучшает исходы и сокращает сроки акинетического криза. Окончательный механизм действия метилпреднизолона при акинетическом кризе не ясен. В экспериментальной модели на крысах было показано наличие глюкокортикоидных рецепторов на дофаминергических нейронах в вентральной области покрышки, за счет стимуляции которых возможно и развивается эффект метилпреднизолона. Имеется сообщение о применении ротиготина в виде трансдермальной терапевтической системы при акинетическом кризе [7].
Злокачественный нейролептический синдром Злокачественный нейролептический синдром – это ятрогенная, потенциально фатальная патология, которая может развиться на фоне приема любых препаратов, блокирующих дофаминергическую передачу. Чаще всего данный синдром развивается в ответ на прием типичных нейролептиков, однако описаны случаи развития ЗНС и при терапии атипичными нейролептиками. Патогенез ЗНС связан с блокадой дофаминергических структур в базальных ганглиях и гипоталамусе, иммунологическими нарушениями и повышением проницаемости гематоэнцефалического барьера, которые приводят к нейросенсибилизации организма с последующим аутоиммунным поражением ЦНС и висцеральных органов. В патогенезе ЗНС важную роль играет симпатоадреналовая и серотониновая гиперактивность.
Частота встречаемости ЗНС составляет 0,1–1% среди больных, получающих нейролептики. В данную группу попадают и пациенты с БП, течение которой осложнилось психотическими расстройствами. Чаще всего ЗНС развивается в первые дни после начала приема препарата, либо резкого увеличения его дозы. ЗНС может проявиться в любом возрасте, но чаще наблюдается у молодых мужчин. Факторами риска при ЗНС являются интеркуррентная инфекция, физическое истощение, нарушения водно-электролитного баланса (в первую очередь дегидратация), также, как и при АГС.
Клиническая картина ЗНС во многом схожа с АГС: характерно быстрое прогрессирование симптоматики с пиком в течение 72 часов, длительностью 7-14 дней. В случае ЗНС возможно купирование симптоматики без дополнительной терапии.
В 1985 г. Levenson J.L. впервые предложил критерии диагностики данной патологии [8], позже, в 1994 г., новые критерии были предложены в рамках DSM-IV:
Для ЗНС характерны изменения лабораторных показателей:
— повышение креатинкиназы (>90%);
— полиморфонуклеарный лейкоцитоз (75%);
Levenson J.L., 1985
DSM-IV, 1994
Паркинсонизм и его основные нозологические формы
Болезнь Паркинсона (БП) – хроническое, неуклонно прогрессирующее заболевание центральной нервной системы.
Болезнь Паркинсона (БП) – хроническое, неуклонно прогрессирующее заболевание центральной нервной системы с дегенерацией нигростриарных нейронов и нарушением функции базальных ганглиев. Она относится к одним из наиболее частых нейродегенеративных заболеваний, которые стоят на третьем месте среди причин смертности после сердечно-сосудистых и онкологических заболеваний.
Паркинсонизм известен давно, первые сообщения о лечении похожих расстройств были сделаны 1000-2500 лет до н.э.
Первое клиническое описание принадлежит английскому врачу Джеймсу Паркинсону, который опубликовал в 1817 году «Эссе о дрожательном параличе».
Подробный клинический анализ комплекса патологии был сделан в 1879 г. знаменитым французским неврологом Жаном Мартеном Шарко.
В настоящее время в классификации паркинсонизма выделяют:
I. Болезнь Паркинсона (она составляет около 70-80% всех регистрируемых случаев).
II. Вторичный (симптоматический) паркинсонизм (около 15%) включает следующие варианты: лекарственный, токсический, постгипоксический, энцефалитический, травматический, при объемных процессах, при гидроцефалии, сосудистый.
III. Паркинсонизм при различных дегенеративных заболеваниях с поражением экстрапирамидной системы («паркинсонизм-плюс», около 10%): мультисистемные атрофии (стриатонигральная дегенерация, оливопонтоцеребеллярная дегенерация), прогрессирующий надъядерный паралич (болезнь Стила-Ричардсона-Ольшевского), кортикобазальная дегенерация, деменция с тельцами Леви, паркинсонизм-БАС-деменция, болезнь Вильсона-Коновалова, болезнь Гентингтона (ювенильный вариант Вестфаля), болезнь Фара (идиопатическая кальцификация базальных ганглиев), болезнь Альцгеймера, другие.
Основной нозологической формой паркинсонизма является болезнь Паркинсона.
Этиология БП неизвестна. В основе ее патогенеза лежит дегенерация так называемых дофаминергических нейронов. БП носит преимущественно спорадический характер, однако при наличии БП у ближайших родственников риск ее развития возрастает.
Клинические проявления БП возникают при уменьшении количества дофамина в хвостатом ядре и скорлупе не менее чем на 70%. Симптомы БП развиваются постепенно, вовлекая сперва конечности на одной стороне. Для клинической картины БП характерно сочетание гипокинезии, ригидности, тремора покоя, и постуральных нарушений.
Гипокинезия проявляется снижением двигательной активности, замедленностью движений, уменьшением амплитуды действий.
Тремор покоя в классических случаях начинается с дистальных отделов верхней или нижней конечности и напоминает движения рук «при счете монет или скатывании пилюль». В дальнейшем в тремор вовлекается гомолатеральная конечность, нижняя челюсть, противоположные конечности. Иногда отмечается постуральное дрожание рук.
Кроме двигательных нарушений, при БП части развиваются недвигательные проявления: нервно-психические расстройства; нарушения сна; вегетативные нарушения; чувствительные нарушения.
В зависимости от преобладания того или иного симптома в клинической картине БП принято выделять следующие клинические формы заболевания: дрожательную, акинетическую, а также смешанные формы — акинетико-ригидную и ригидно-дрожательную.
На поздних стадиях БП клиническая картина видоизменяется, появляются дополнительные моторные (двигательные флуктуации, лекарственные дискинезии, нарушения ходьбы, падения, застывания и акинетические кризы) и немоторные (вегетативные, когнитивные, нейропсихические) синдромы.
У больных могут возникать длительные периоды декомпенсаций — от нескольких дней до нескольких недель, а также акинетические кризы — тяжелые эпизоды акинезии, сопровождающиеся дисфагией, вегетативными нарушениями, гипертермией, олигурией, спутанностью сознания. Причинами этого могут являться: нарушение схемы приема противопаркинсонических средств, их полная отмена («лекарственные каникулы»); прием препаратов, блокирующих ДА-рецепторы (прежде всего нейролептики); обострение сопутствующих соматических заболеваний, стресс; операции, травмы, дегидратация организма.
Диагностировать БП с уверенностью можно только с помощью аутопсии. Клиническая диагностика синдрома паркинсонизма требует обязательного наличия гипокинезии и не менее одного из трех основных симптомов паркинсонизма: тремора покоя, ригидности и постуральной неустойчивости.
Проведение МРТ головного мозга является обязательным при наличии у больного синдрома паркинсонизма. Данное исследование прежде всего необходимо для дифференцирования идиопатической болезни Паркинсона и вторичного паркинсонизма, а также «паркинсонизма-плюс».
Основными направлениями лечения БП являются:
1. Фармакотерапия.
2. Медико-социальная реабилитация.
3. Лечебная физическая культура (ЛФК).
4. Нейрохирургическое лечение.
Фармакотерапия при БП направлена на нормализацию биохимического дисбаланса и требует постоянного приема лекарственных средств, так как при прекращении лечения симптомы БП возвращаются к исходному уровню.
На ранней стадии лечение БП заключается в назначении монотерапии с последующим переходом на комбинированное лечение.
На ранних стадиях заболевания общепринятым является назначение больным в возрасте до 70 лет агонистов ДА-рецепторов и ингибиторов МАО-В в виде монотерапии или сочетания.
У пациентов старше 70 лет, когда ожидаемая продолжительность жизни больного меньше, а также имеются когнитивные нарушения, терапию можно сразу начинать с ДОФА-содержащих препаратов в минимальной эффективной дозе, которую подбирают постепенно.
Холинолитики (Циклодол, Акинетон) назначаются преимущественно на ранней стадии БП — в виде монотерапии или в комбинации с другими противопаркинсоническими средствами; они преимущественно влияют на тремор покоя.
В настоящее время их назначают лишь молодым пациентам, с выраженным тремором покоя и сохранными когнитивными функциями. Высокая частота побочных эффектов и низкая эффективность по сравнению с другими группами существенно ограничивают их применение.
Препараты амантадина (Мидантан, ПК-Мерц).
Амантадины могут назначаться как при начальной стадии в виде монотерапии, так и в комбинации с другими противопаркинсоническими средствами на поздних стадиях БП. Препараты эффективны и для уменьшении степени выраженности дискинезий, вызванных приемом леводопы. Инфузионная форма амантадина сульфата (ПК-Мерц) применяется при лечении декомпенсаций и акинетических кризов при БП.
Агонисты дофаминовых рецепторов обладают способностью непосредственно стимулировать ДА рецепторы в головном мозге. Неэрголиновые агонисты ДА-рецепторов (Проноран, Мирапекс, Реквип Модутаб, Ньюпро) широко применяются на всех стадиях БП. Помимо контроля двигательных нарушений, у них выявлен антидепрессивный эффект, что очень важно, так как частота депрессивного синдрома при БП достаточно высока.
Монотерапия АДАР на ранних стадиях заболевания позволяет отсрочить назначение препаратов леводопы, а также развитие моторных флюктуаций и лекарственных дискинезий.
Ингибиторы МАО типа В (Разагилин). Назначение препаратов этой группы приводит к увеличению количества дофамина в нейронах. Также предполагается наличие у них нейропротекторного действия. Могут назначаться на ранних стадиях в виде монотерапии, а также в комбинации с леводопой.
Ингибиторы КОМТ. Ингибиторы КОМТ увеличивают биодоступность леводопы, уменьшая уровень ее неактивных метаболитов.
Ингибиторы КОМТ периферического действия не проходят ГЭБ и препятствуют метилированию леводопы в желудочно-кишечном тракте и кровеносном русле. Благодаря этому они сохраняют концентрацию леводопы на определенном уровне. К таким препаратам относится энтакапон.
Комбинация энтакапона с препаратами леводопы позволяет снизить суточную дозу ДОФА-содержащего препарата на 15–30%.
Он назначается только в комбинации с препаратами леводопы (Сталево), так как при назначении в виде монотерапии самостоятельным противопаркинсоническим эффектом не обладает.
Препараты леводопы (Мадопар, Наком, Тремонорм, Тидомет-форте, Дуэллин, Синдопа). Дофамин не проходит ГЭБ, поэтому в качестве лекарственного препарата был предложен метаболический предшественник дофамина — леводопа, которая проходит через ГЭБ и в головном мозге метаболизируется в дофамин. На сегодняшний день препараты леводопы являются наиболее эффективными лекарственными средствами, «золотым стандартом», применяющимися для лечения БП. Однако они не останавливают прогрессирование БП. Более того, в среднем после 5 лет применения ДОФА-содержащих средств у больных БП снижается их эффект, появляются двигательные флюктуации и лекарственные дискинезии.
Сроки назначения терапии препаратами леводопы зависят от степени выраженности и темпа прогрессирования заболевания, профессиональной деятельности больного, семейно-бытового статуса. В целом назначать препараты этой группы необходимо, когда имеются выраженные двигательные нарушения, которые не удается купировать другими противопаркинсоническими средствами.
Нейрохирургическое лечение.
Снижение эффективности фармакотерапии, появление моторных флюктуаций и лекарственных дискинезий являются показанием к применению нейрохирургического лечения, которое в течение последних двух десятилетий прочно заняло свое место в алгоритме ведения пациентов с БП.
В настоящее время используются три типа нейрохирургических вмешательств при БП: стереотаксические деструктивные методы (вентролатеральная таламотомия, паллидотомия, субталамотомия и их комбинация), стимуляционные методы (имплантация электродов в подкорковые структуры с последующей их хронической электростимуляцией) и внутримозговая трансплантация дофаминергических нейронов мезенцефалона эмбриона человека, эффективность которой продолжает изучаться.
Наиболее современный метод хирургического лечения БП – глубокая электростимуляция головного мозга. Процедура ГСМ состоит в имплантации электродов с 4 контактами в зоны-мишени в пределах подкорковых образований головного мозга; электроды соединяются с имплантируемым под кожу стимулятором, подающим высокочастотные электрические импульсы в стимулируемое ядро.
Медико-социальная реабилитация.
Высокая степень инвалидизации при неуклонно прогрессирующей БП, социально-экономические потери, которые несет общество обусловливают необходимость создания системы медико-социальной реабилитации, которая должна включать в себя диспансерное наблюдение больных; создание школ для пациентов и их родственников ведение обучающих программ и психотерапевтических занятий, создание общественных организаций, групп поддержки.
Большое значение имеет ЛФК, которая может подбираться индивидуально в зависимости от степени тяжести болезни у конкретного больного, занятия ЛФК в группах, танцевальная терапия, а также трудотерапия, физиотерапия.
Болезнь Паркинсона

С.Н. Иллариошкин
доктор медицинских наук, профессор, заместитель директора по научной работе
ГУ НИИ неврологии РАМН
Все указанные проявления свидетельствуют о глубокой перестройке химических процессов в мозге на фоне болезни и проводимой терапии. Их адекватная коррекция или, во всяком случае, сведение к минимуму являются важнейшей задачей лечащего врача, которая осуществляется путем тщательного подбора наиболее рациональной комбинации тех или иных противопаркинсонических препаратов, имеющихся в распоряжении современной неврологии.
Появление симптоматики при болезни Паркинсона свидетельствует об уже далеко зашедших процессах в центральной нервной системе: считается, что первые симптомы манифестируют, когда погибло не менее 70% нервных клеток в черной субстанции. Однажды начавшись, болезнь Паркинсона характеризуется хроническим течением и неуклонным прогрессированием в определенном темпе на протяжении жизни. Именно поэтому при лечении таких пациентов особенно важным является применение не только симптоматических средств, облегчающих отдельные проявления болезни, но и препаратов, обладающих защитным (протективным) действием и замедляющих нарастание неблагоприятных дегенеративных изменений в головном мозге.
© Газета «Академия хорошего здоровья», 2005, №2
Болезнь Паркинсона
Болезнь Паркинсона определяется по четырем характерным признакам, которые составляют тетраду паркинсонизма:
Паркинсонизм относится к распространенным неврологическим заболеваниям, им страдает 120 – 180 человек из 100 тысяч, причем болезнь имеет выраженную возрастную зависимость.


Причины
Болезнь Паркинсона бывает двух типов. Первый – истинный паркинсонизм, он составляет до 80% случаев заболевания.
Второй – синдром паркинсонизма, который сопутствует черепно-мозговым травмам, энцефалиту, инсульту, опухолям головного мозга.
Причины истинного паркинсонизма, или болезни Паркинсона, в точности неизвестны.
Но установлено несколько фактов:
болезнь развивается преимущественно в пожилом возрасте (после 60 лет),
дегенеративные изменения начинаются с необратимого процесса отмирания нейронов ствола головного мозга,
развитие симптомов заболевания связано с недостатком дофамина – нейромедиатора, от которого зависит передача сигналов в межнейронных связях,
существует генетическая предрасположенность.
Примерно в 15% случаев болезнь Паркинсона возникает на фоне негативного семейного анамнеза (наличия заболевания у близких родственников), передается по наследству.
Некоторые факторы могут повлиять на развитие заболевания:
Симптомы
Развитие болезни Паркинсона напрямую связано с недостатком дофамина – это один из нейромедиаторов, которые обеспечивают передачу сигналов в межнейронных связях. То есть проводимость нервных волокон.
Недостаток дофамина приводит к тому, что сигналы в межнейронных связях «зависают», скорость их передачи резко снижается, это приводит к нарушению двигательных функций и умственных способностей.
Вот почему болезнь Паркинсона всегда сопровождается одновременно двигательными и умственными нарушениями.
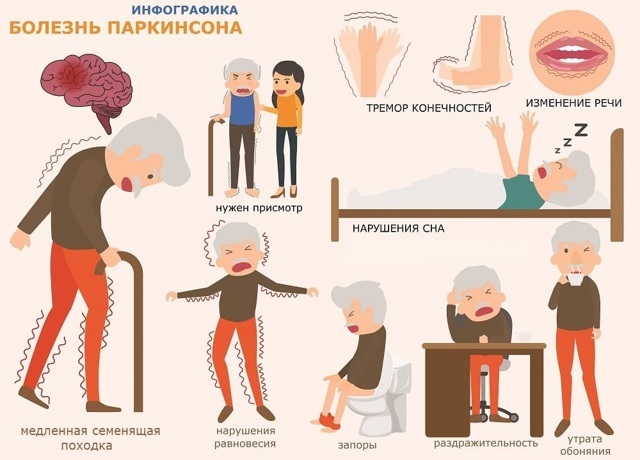
Первые признаки заболевания редко служат поводом для беспокойства – это скованность движений в правой половине тела, подергивание (дрожание) рук, жирность кожи, волос, частые депрессивные состояния, запоры.
Со временем возникает выраженный тремор – дрожание руки, ноги, а затем головы, непроизвольные движения пальцами.
На ранней стадии тремор охватывает только одну руку (ногу), а затем распространяется на вторую. Дрожание всегда начинается с конечности, тремор головы присоединяется с развитием заболевания.
Движения человека становятся замедленными, походка шаркающей. Он передвигается мелкими шажками, прежде чем развернуться, топчется на месте.
Мимика все больше обедняется. Лицо становится неподвижным, лишается выражений. Возникает впечатление, что человек ни на что не реагирует.
Мышцы становятся все менее подвижными, ригидными, человеку становится трудно совершать движения, их объем все больше ограничивается. Он не может застегнуть пуговицы, завязать шнурки, побриться, почистить зубы и со временем полностью утрачивает способность обслуживать себя в быту.
Изменяется речь – она становится неразборчивой, тихой, монотонной.
Со временем клиническая картина дополняется все новыми симптомами:
Формы заболевания
Формы болезни Паркинсона определяются в зависимости от того, какой из симптомов наиболее выражен.
1. Дрожательная форма – преобладает дрожь (тремор) в руке, ноге или обеих руках, ногах, голове, причем наиболее выражен тремор в покое. При движениях он может ослабевать или даже исчезать.
2. Ригидная форма – характеризуется скованностью в мышцах, особенно при начале движений, ограниченной подвижностью.
3. Акинетическая форма – характеризуется замедленностью движений, обеднением или полным отсутствием мимики.
Наряду с этими тремя основными формами различают смешанные – ригидно-дрожательную, дрожательно-ригидную, акинетико-ригидную, др.
Стадии
В развитии болезни Паркинсона выделяют пять основных стадий.
На 1 стадии дрожание проявляется только в одной руке или ноге. Обычно болезнь проявляется подрагиванием пальцев правой руки.
На 2 стадии дрожание (тремор) распространяется на вторую руку (ногу). Нарушается сон, ухудшается аппетит, возникает обильное слюнотечение, начинает подергиваться подбородок.
На 3 стадии нарушается равновесие, изменяется поза тела, походка становится шаркающей, медленной, но человек еще может совершать обычные бытовые движения, обслуживать себя. Тремор все больше усиливается, нарушается речь, лицо становится безэмоциональным.
На 4 стадии изменения походки, позы тела становятся все более выраженными. При ходьбе человек может падать. Он еще может ходить, но уже не может совершать простые действия, самостоятельно обслуживать себя (застегивать пуговицы, держать ложку). Развивается депрессия.
На 5 стадии человек теряет способность передвигаться (ходить, стоять, сидеть), координация движений утрачивается. Речь становится неразборчивой, невнятной, нарушаются глотание, мочеиспускание. Без посторонней помощи его жизнь становится невозможной.
Диагностика
На первичном приеме врач Международной клиники Медика24 расспрашивает пациента (или его близких) о симптомах, времени их появления, динамике развития, а также о наличии заболеваний в семье. Это называется сбором персонального и семейного анамнеза.
После этого врач проводит внешний осмотр, обращая внимание на нарушения координации, движений, позы тела, использует несколько тестов, чтобы оценить степень ригидности, акинезии (например, тест на сжимание-разжимание кулака, др.).
При диагностике врач должен дифференцировать болезнь Паркинсона от многих неврологических расстройств по наличию инсультов, терапии нейролептиками, наличиям продолжительных ремиссий (болезнь Паркинсона развивается без ремиссий), черепно-мозговых травм, энцефалита в анамнезе и ряду других признаков.
После установления предварительного диагноза, при подозрении на болезнь Паркинсона врач направляет пациента на дополнительные обследования.
Это метод исследования с помощью слабого высокочастотного электрического тока, который показывает характер кровообращения головного мозга.
ЭЭГ помогает оценить общую и локальную функциональную активность головного мозга, выявить патологические очаги.
3. Компьютерная томография.
КТ головного мозга дает подробную картину кровообращения, состояния нервных тканей головного мозга, помогает обнаружить патологические участки, опухоли.
4. Магнитно-резонансная томография.
МРТ головного мозга выполняется посредством магнитного поля и, в отличие от КТ, не оказывает лучевой нагрузки на мозг. Поэтому этот вид обследования может проводиться многократно. МРТ помогает подробно исследовать состояние нервных тканей мозга, обнаружить участки повреждения нейронов.
Наряду с этими основными методами диагностики применяются лабораторные анализы, а при необходимости и другие высокотехнологичные, современные обследования, которые позволяют нее только уточнить диагноз, но и определить лучшую тактику лечения.

Лечение
Основным медикаментозным средством лечения болезни Паркинсона является леводопа.
Это симптоматическое средство, которое восполняет недостаток дофамина и таким образом устраняет главную причину симптомов заболевания – гипокинезии, тремора, ригидности.
Для стимуляции синтеза дофамина в головном мозге и повышения его уровня в межнейронных синапсах применяются селективные ингибиторы МАО-В (селегилин), амантадин, пирибедил, прамипексол.
В комплексной терапии заболевания применяются также:
Лечение болезни Паркинсона на поздних стадиях осложняется тем, что эффект применения леводопы снижается, усиливаются побочные эффекты.
Все это требует постоянного врачебного наблюдения и своевременной коррекции медикаментозной терапии, назначения дополнительных препаратов, изменений дозировки.
На последней стадии развития заболевания больной нуждается в профессиональном медицинском уходе, который в полной мере можно обеспечить только в условиях стационара.
Медицинский уход и симптоматическая терапия в Международной клинике Медика24 помогают повысить качество жизни и увеличить ее продолжительность, замедлить развитие болезни Паркинсона на поздней стадии.
