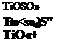Краткое техническое описание диоксида титана
Двуокись титана отличается высокой реакционной устойчивостью к различным соединениям, в том числе и к токсичным, содержащимся в воздушной среде. Из-за своей инертности, диоксид титана не токсичен и, в общем, считается очень безопасным веществом. Он может контактировать с продуктами в упаковке, а в определенных концентрациях его можно использовать и как пищевой краситель.
Затрудняетесь с выбором оптимальной марки диоксида титана для конкретной области применения? Ищете поставщика? Тогда вам сюда:
Рутил или анатаз?!
К тому же, анатаз менее атмосферостоек, чем рутил. Анатаз гораздо хуже работает в защите полимера (акрилата, пластмассы) от УФ лучей и приводит к фотокатализу (разрушению материала под воздействием солнечного света) и потере свойств полимера (происходит деструкция, выцветание, меление и т.д.).
Таким образом, именно рутильная форма диоксида титана является единственным и безальтернативным белым пигментом в стандартных областях промышленности (краски, пластмассы, бумага) для придания белизны, укрывистости (кол-во пигмента в граммах, чтобы укрыть 1 кв. м. контрастной поверхности) и стабильности системе пигмент + носитель.
Единственное обоснованное применение анатазного титана – это краски для дорожной разметки. В данном типе карски проявляются некоторые специфические свойства данной формы.
Производство хлорное или сульфатное?
Пигменты двуокиси титана производятся по двум технологическим схемам: сульфатный и хлорный способы. Обе, анатазная и рутильная формы диоксида титана, могут быть произведены любым из способов. Мировые мощности по производству диоксида титана хлорным способом превышают мощности сульфатного, и продолжают расти. Различия в техпроцессе заключаются в различных типах вещества для очистки титановой руды.
При очистке серной кислотой (сульфатный процесс), частички примесей титановой руды образуют с серной кислотой соли, которые сложно в дальнейшем вычистить. При очистке хлором происходит сгорание примесей и конечный продукт получается более белым при прочих равных условиях.
Оптические свойства
Главное свойство титана как пигмента – придавать яркий белый цвет носителю, куда он вносится. Цвет определяется в системе цветов Lab, где L – яркость цвета, а – краснота/зелень, b – желтизна/голубизна. В этой системе можно задать любой цвет.
Поскольку диоксид титана белый либо бело-жёлтый пигмент, то обычно указывается только координаты L и b. На цвет конечного продукта помимо основных параметров очистки также влияет размер частиц. Так, например, среднеразмерные и крупнорзамерные диоксиды титана (от 25 нм) показывают высокую укрывистость и кроющую силу при содержании пигмента в связующем 15-30%. Данная концентрация стандартная величина для большинства красок. При концентрации пигмента 10%, как например в пластиках, мелкие частицы диоксида титана обеспечивают хорошую укрывистость и кроющую силу.
Научное обоснование феномена. Так как рутиловые пигменты абсорбируют излучение в ультрафиолетовой и коротковолновой области света, то появляются незначительная нехватка отражённого коротковолнового синего света, что приводит к лёгкому жёлтому оттенку. Смещая гранулометрический состав пигмента в сторону более мелких частиц, можно компенсировать это эффект. Можно также получить голубоватый оттенок в серых и цветных красках за счёт создания более узкого диапазона размера частиц.
Дополнительная обработка
Для того чтобы обеспечить выполнение разнообразных специфических требований, предъявляемых к применению и технологическим свойствам диоксида титана, чистый пигмент подвергается поверхностной обработке. При обработке поверхности неорганическими веществами частицы пигмента обволакиваются обычно соединениями Al2O3 и SiO2.
Эта оболочка служит в первую очередь для сдерживания фотокаталистического разложения материала. Обычно добавляются вышеуказанные добавки в количестве около 1-5%. Высокие концентрации окислов уменьшают рассеивающую способность пигмента. Поэтому приходится искать компромисс между высокой рассеивающей способностью и уменьшением фотокаталитической активности.
Для адаптации пигмента к условиям переработки их покрывают второй оборочкой из полиолей (органическое вещ-во). Эта оболочка приводит к уменьшению полярности поверхности оболочки пигмента. В результате этого уменьшается смачиваемость частиц пигмента молекулами полимера, что приводит к хорошей диспергируемости. Кроме того, улучшается транспортабельность пигмента и уменьшается его влагопоглощение.
Разбеливающая способность (кроющая сила)
Способность белого пигмента увеличивать яркость цветной, серой или чёрной среды называется разбеливающей способностью и измеряется как изменение яркости, достигаемое за счёт испытуемого пигмента в стандартной рецептуре. Так как этот показатель зависит от многих факторов, его сравнивают с разбеливающей способностью эталонного пигмента. Т.о. получается относительная величина, рассчитываемая по сложной формуле. Определённая таким образом разбеливающая способность является мерилом оптической эффективности пигмента.
Никакой пигмент, даже стабилизированный наилучшим образом, не в состоянии полностью предотвратить фотохимическое разложение материала. Молекулы материала на границе с окружающей средой защищаются пигментом не на вечные времена. В конце концов наступает медленно прогрессирующая деполимеризация, выражающаяся в послойном обнажении пигмента, приводящем сначала к к потере блеска, а затем к мелению. Период отсутствия меления является показателем для определения атмосферостойкости.
Под диспергируемостью пигмента понимают его склонность к дезагломерированию под воздействием небольших усилий сдвига и тонкому распределению по материалу. Эти характеристики являются непременными условиями полного проявления свойств пигмента и предотвращения дефектов поверхности. Под диспергированием пигмента понимают процесс его перетира на различном оборудовании (диссольвер или бисерная мельница). Через регламентированное время перетира проверяют размер частиц.
Диоксид титана

Анатазная обладает меньшим коэффициентом преломления (2,55 против 2,70 у рутильной) соответственно, меньшей укрывистостью и меньшей абразивностью (ниже твердость по шкале Мооса), а также значительно большей фотохимической активностью. Потому анатазная модификация используется в основном при производстве бумаги, пластмасс и специальных видов ЛКМ (самоочищающиеся покрытия). Рутильная модификация применяется для производства широкого спектра ЛКМ и пластиков.
Диоксид титана
Способы производства пигментного диоксида титана
Существуют два способа производства пигментного диоксида титана: сульфатный и хлоридный. Ниже представлена подробная схема производства двуокиси титана.

Производители диоксида титана
АО «Афая» представляет на российском рынке диоксиды титана производства «Venator» (бывш. «Huntsman P&A»). В ассортименте рутильных пигментных диоксидов титана представлены две основные продуктовые линейки: Tioxide и Sachtleben.

Для всех марок двуокиси титана характерны высокая укрывистость, хорошая диспергируемость, постоянство пигментных характеристик от партии к партии. Что касается атмосферостойкости (фотохимической активности), то весь ассортимент можно условно разделить на три группы:
Диоксиды титана используют не только при производстве белых красок, но и цветных, а также в колеровочных системах для индустриальных и строительных ЛКМ. Очень важными характеристиками в этом случае будут разбеливающая способность и оттенок пигмента в разбеле.

Кроме стандартных пигментных марок «Venator» выпускает несколько продуктовых линеек специальных марок диоксидов титана: Hombitec, UV-Titan, Altiris.
Что такое титановые белила и почему эта пищевая добавка больше не считается безопасной
Пищевая добавка E171, представляющая собой порошок диоксида титана, — распространенный компонент многих продуктов питания. Раньше считалось, что благодаря химической инертности она полностью безопасна для человека, но весной 2021 года выяснилось, что это не совсем так. Почему исследователи пришли к такому выводу? Рассказывает химик Илья Чикунов.
Что такое диоксид титана и «с чем его едят»
В зависимости от желаемой кристаллической полиморфной модификации диоксид титана производят либо сульфатным, либо хлоридным способом. Анатазная форма диоксида титана может быть получена только в результате сульфатного процесса, а рутиловая — обоими способами. В настоящее время E171 состоит из чистого анатаза и/или рутила. До 2006 года для применения в пищевой промышленности разрешалась только анатазная форма. Рутил допускается для замены анатаза в пищевых продуктах, особенно в пленочных покрытиях для таблеток, пищевых добавок и продуктов питания. В структурах анатаза и рутила основной строительный блок состоит из атома титана, окруженного шестью атомами кислорода. Структуры различаются искажением и сборкой октаэдров — в рутиле они соединены через углы и грани (рис. 1).
 Рис. 1. Объемные структуры анатаза (слева) и рутила (справа)
Рис. 1. Объемные структуры анатаза (слева) и рутила (справа)
Хотя обе формы разрешены к применению в пищевых продуктах, характеристика образцов, полученная в американских и европейских лабораториях, показывает, что преобладает анатаз. Например, пять из шести жевательных резинок содержали TiO2 в виде анатаза и только одна включала смесь анатаза и рутила.
Пищевые продукты, содержащие TiO2
Читайте также
Диоксид титана обнаружен в жевательных резинках, кондитерских изделиях, соусах и заправках, немолочных сливках и в диетических добавках. По сведениям о новых продуктах, представленных на рынке 62 крупнейших экономик мира, использование TiO2 постоянно увеличивалось до 2014 года; Е171 входит в состав более чем 3500 продуктов питания или напитков.
TiO2 присутствует в 51% жевательных резинок, 25% помад, жидкостей и спреев, 21% смешанных продуктов, 10% пастилок, желе и жевательных конфет и 10% леденцов.
Жевательные резинки и кондитерские изделия, включая пастилки, желе и жевательные конфеты, — самые распространенные категории продуктов питания, содержащих TiO2. Торты и пирожные представляют собой вторую по значимости категорию. Количество TiO2 в коммерческих продуктах показывает, что жевательные резинки являются наиболее богатыми диоксидом титана и содержат до 5,4 мг/г. Следующая категория — сладости с содержанием до 2,5 мг/г, затем кондитерские изделия — до 0,5 мг/г продукта, в съедобных украшениях, покрытиях и начинках — до 20 мг/г, в обработанных орехах 3,8 мг/г, в пищевых добавках 2,8 мг/г и в салатах и сэндвич-спредах на основе соленых продуктов 2,5 мг/г продукта.
Сколько TiO2 съедает человек?
Количество TiO2, потребляемого в США ежедневно, оценивалось примерно в 0,2–0,7 мг TiO2 на кг массы тела в день (мг/кг/д), в то время как население Великобритании и Германии потребляет около 1 мг TiO22/кг/д. Независимо от сценария воздействия и методологического выбора наибольшее количество TiO2 употребляют дети (3–9 лет) и подростки (10–17 лет). Вклад жевательных резинок незначителен по сравнению с кондитерскими изделиями, включая выпечку, освежающие дыхание конфеты, соусы, салаты и спреды для сэндвичей, безалкогольные напитки и сыр. В исследовании, основанном на данных Голландского национального исследования потребления продуктов питания, продуктами, вносящими наибольший вклад в потребление TiO2 детьми младшего возраста (2–6 лет), являются кондитерские изделия (сладости, шоколадные изделия и жевательные резинки) и мелкая выпечка (печенье и проч.). Помимо пищевых продуктов таблетированные лекарства и пищевые добавки содержат до 3,6 мг/г TiO2.
Судьба TiO2 в живом организме
После приема внутрь частицы TiO2 проходят через пищеварительный тракт, начиная с ротовой полости, за которой следует желудочно-кишечный тракт (ЖКТ), включающий пищевод, желудок, тонкий и толстый кишечник и прямую кишку. Во время прохождения через пищеварительные жидкости частицы TiO2 в основном агломерируются под воздействием белков и электролитов, но небольшая часть всё еще находится в наноразмерном диапазоне. При диспергировании агломераты способны разрушаться, что приводит к увеличению количества «свободных» наночастиц. На степень агломерации и количество «свободных» наночастиц дополнительно могут влиять условия в пищевых продуктах и в среде ЖКТ. Низкая абсорбция TiO2 и, наоборот, высокий процент диоксида титана, выводимого из организма с фекалиями, ранее считались доказательством отсутствия какого-либо неблагоприятного эффекта. Однако новые данные о кишечном отделе ставят это под сомнение. Частицы TiO2, независимо от их размера и гидрофильности/гидрофобности, способны проникать через слизь в нижележащие ткани.
Когда частицы TiO2 преодолевают защитную триаду слизь — микробиота — эпителий, они в некотором количестве попадают в системную циркуляцию и проникают в печень и почки, а также обнаруживаются в легких, селезенке и мозге с периодом полувыведения 12,7 дня, что показано на грызунах. Группа экспертов сочла, что Е171 имеет низкую пероральную системную доступность, не выше 0,5%, но может проходить через плаценту и передаваться плоду. Исследования на крысах показали длительный, 200–450 дней, период полувыведения частиц с размером 7–90 нм. Следовательно, в организме накопленные частицы TiO2 регулярно пополняются, что предполагает биоаккумуляцию, то есть накопление в организме. В тканях умерших людей частицы TiO2 обнаружены в печени, селезенке, почках и кишечнике.
У мышей, подвергавшихся пероральному воздействию наночастиц 
Переоценка безопасности Е171
Группа экспертов в мае 2021 года поменяла оценку безопасности пищевой добавки TiO2 (Е171) в соответствии с запросом Европейской комиссии от марта 2020-го. В масштабном документе, содержащем ссылки на 323 научные публикации, пересмотрены результаты предыдущей рекомендации EFSA от 2016 года, где подчеркивалась необходимость дополнительного изучения биологических свойств TiO2. Председатель группы экспертов заявил:
«Принимая во внимание все имеющиеся научные данные, группа заключила, что диоксид титана больше не может считаться безопасной пищевой добавкой. Важнейшим элементом для этого вывода является то, что мы не смогли отвергнуть опасения по генотоксичности частиц диоксида титана после его употребления. После приема внутрь всасывание частиц невелико, но они способны накапливаться в организме».
Оценка проводилась в том числе с учетом актуальных сведений о наночастицах, которые появились со времени заключения EFSA от 2016 года. Эксперты впервые применили Руководство научного комитета EFSA по нанотехнологиям (EFSA Scientific Committee Guidance on Nanotechnology) 2018 года к оценке безопасности пищевых добавок. Краситель Е171 содержит до 50% частиц в нанодиапазоне (то есть меньше 100 нанометров), воздействию которых подвергаются потребители.
Эксперты опасаются риска генотоксичности, при этом определить ежедневные безопасные количества добавки Е171 оказалось невозможным. Специалисты по управлению рисками Европейской комиссии были проинформированы о выводах EFSA и будут разрабатывать соответствующие регулирующие меры, чтобы обеспечить безопасность потребителей.
Может быть интересно
Национальное агентство по безопасности пищевых продуктов, окружающей среды и гигиены труда Франции (ANSES), рассмотрев риски, связанные с воздействием пищевой добавки Е171, добилось того, что в 2019 году использование TiO2 в пищевых продуктах было запрещено.
Параллельно Управление по безопасности продуктов питания и потребительских товаров (Нидерланды, NVWA) пришло к заключению о потенциально опасных для здоровья последствиях употребления TiO2; представителями NVWA подчеркивалась важность изучения иммунотоксикологических эффектов в дополнение к потенциальным последствиям репротоксикологического характера.
Что обнаружили эксперты
Заключение экспертов основано на новых научных данных, которые их группа сочла достоверными, включая результаты расширенного исследования репродуктивной токсичности в одном поколении (EOGRT). Основные выводы, которые могут стать поводом для запрета добавки Е171, таковы:
После публикации заключения руководитель Роспотребнадзора РФ А. Попова заявила, что исследовательским подразделениям поручено тщательно изучить действие Е171. Ранее токсико-гигиеническую оценку TiO2 проводили в 2019 году и пришли к выводу, что существуют риски, обусловленные наноразмерным TiO2, при его употреблении внутрь. Отметим, что продукты и изделия, которые не являются пищевыми, опасности не представляют.
Лако-красочные материалы — производство
Технологии и оборудование для изготовления красок, ЛКМ
Диоксид титана
Диоксид титана (двуокись титана) TiOa полиморфен, он кристаллизуется в двух сингониях: брукит — в ромбической, рутил и анатаз — в тетрагональной, но последние различаются строением кристаллической решетки. В обоих случаях каждый атом титана находится в центре октаэдра и окружен 6 атомами кислорода. Пространственное же расположение октаэдров разное: в анатазе на каждый октаэдр приходится 4 общих ребра, в рутиле только 2 (DHC. 2.П. Япементяпняя
Название и химический состав
Насыпной объем VK. J-103, м*/кг
Диоксид титана пиг-
ячейка анатаэа состоит из четырех молекул, а рутила только из двух:
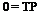
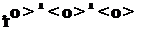 T T T рутил » title=»Диоксид титана» align=»left» width=»142″ height=»32 src=»http://kraska.biz/pigmenty/dioksid-titana-3/style=»margin-top:44px; margin-bottom:0px»/>
T T T рутил » title=»Диоксид титана» align=»left» width=»142″ height=»32 src=»http://kraska.biz/pigmenty/dioksid-titana-3/style=»margin-top:44px; margin-bottom:0px»/>
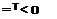
Рутил, прокаленный при температуре около 1000 °С и содержащи: примеси Fe, Cr, Ni, Mn, проявляет свойство фототропии. При освещений он становится коричневым, в темноте вновь светлеет. Это объясняетсяЛ окислением примесных металлов в высшие оксиды вследствие выделения кислорода при освещении ТЮа с деформированной решеткой.
Минимальное количество примесей, внедрение которых в кристаллическую решетку рутила вызывает изменение окраски, составляет (в г ни 1 г ТЮ»): 3-10 * FeaOs — желтая окраска; 1,5-10 ftCraO& — коричневая; 3-10 * МпО» — серая; 7-10 9 VaOj — серо-голубая Диоксид титане, особенно его гидраты, легко адсорбирует оксиды и гидроксиды жежчи, которые придают желтую окраску анатаау уже при содержании 0,009 %, рутилу 0,003 %
В чистом виде диоксид титана, особенно в анатазной форме, обладает высокой фотохимической активностью, что вызывает разруццуцр лако-
(жнейшнх белых пигментов
красочной пленки («меление») и выцветание органических пигментов. Закрытие активных центров поверхности частиц диоксида титана гидроксидами Al, Si, Zn резко уменьшает фотохимическую активность. Такой модифицированный рутильный диоксид титана обладает незначительной фотохимической активностью и пригоден для атмосферостойких ответ* * твенных эмалей для автомашин и сельскохозяйственной техники.
Сырье, для получения диоксида титана. Для переработки в пигментный шоксид титана используются минералы: природный рутил, содержащий ‘)2—95 % (масс.) ТЮг и примесь г»е20з, придающую ему красный цвет (рутил красный); ильменит FeO-TiCb или измененный ильменит — ирканзит Fe203-3Ti02; титаномагнетиты, состоящие из зерен ильменита и магнетита и содержащие 8—12 % (масс.) ТЮа.
В чистом виде титансодержащие минералы встречаются редко. Для освобождения от примесей других минералов и пустой породы измельченные руды подвергают магнитному и другим видам обогащения и получают концентраты. Ниже приведен типовой химический состав гитаномагнетитовых концентратов, % (масс):
Наиболее ценным и перспективным сырьем являются титановые шлаки, получаемые при доменной и особенно электрометаллургической переработке титансодержащих руд и концентратов. Содержание ТЮг в шлаках достигает 80—85 % в легко растворимой в серной кислоте форме.
Технология производства пигментного диоксида титана. Переработка титановых концентратов и шлаков в пигментный диоксид титана имеет целью не только освобождение от примесей FeO, Fe203, СГ2О3, МпОг, V2O5 и других, влияющих на цвет пигмента, но и придание ТЮг требуемой кристаллической формы, дисперсности, адсорбционных свойств и подавление фотохимической активности. Для получения диоксида титана применяют два способа: сернокислотный — для концентратов, содержащих более 40 % ТЮг, и хлоридный,— экономически выгодный только для переработки концентратов, содержащих не менее 80 % ТЮг (так как получаемые отходы FeCb не находят применения).
Сернокислотный способ. Это тонкий и сложный процесс, состоящий из трех основных стадий и ряда вспомогательных операций (см. схему 2.1).
1. Первой стадией является разложение тонкоизмельченного титан — содержащего концентрата 85—92 %-Ной серной кислотой при 180—220 °С и непрерывном перемешивании реакционной массы сжатым воздухом с получением прозрачного раствора тита ни л сульфата TiOS04. При этом протекают следующие экзотермические реакции разложения:
Ti02 + H2S04——- TiOSOi + НгО,
FeO + H2S04—— * FeS04 + Н20,
Fe203 + 3H2S04——- AFe2 (S04)s + 3H20,
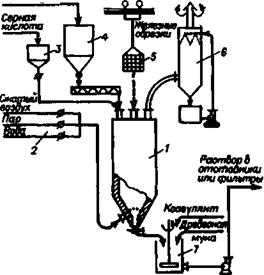 а также аналогичные реакции с оксидами Mn, Ла, A1 и другими примесями. Все реакции протекают бурно после предварительного нагрева — температурного толчка — в течение нескольких минут с выделением большого количества паров воды, H2SO4, SO3 и БОг, которые улавливаются в скруббере, орошаемом водой. Реакцию разложения проводят периодическим методом (рис. 2.2). Поскольку в реакторах периодического действия при проведении главной реакции возможны местные перегревы и выбросы горячих кислых растворов, в целях безопасности реакционные аппараты’ выносят в изолированное помещение.
а также аналогичные реакции с оксидами Mn, Ла, A1 и другими примесями. Все реакции протекают бурно после предварительного нагрева — температурного толчка — в течение нескольких минут с выделением большого количества паров воды, H2SO4, SO3 и БОг, которые улавливаются в скруббере, орошаемом водой. Реакцию разложения проводят периодическим методом (рис. 2.2). Поскольку в реакторах периодического действия при проведении главной реакции возможны местные перегревы и выбросы горячих кислых растворов, в целях безопасности реакционные аппараты’ выносят в изолированное помещение.
Рис. 2.2, Технологическая схема отделения риэложения ильменита н восстановления железа:
/ реактор периодического действия; Ч пули’ управления; 3
мерник серной кислоты; 4
весовой бункер из-j мельчекииго концентрата; б — опускае-, мая в реек гор корзина с железными обрезками; 6″ скруббер для очистки отходящих гизов; 7 — емкость для подготовки растворов титанилсульфата к фильтрованию
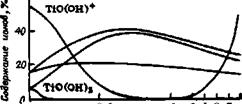
Гидролиз 105 ”С
TiOS04+H80-*Tf0(0H)l+HlS04
 | |||||||||
|