Основные агрегатные состояния вещества

Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.

Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:

Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
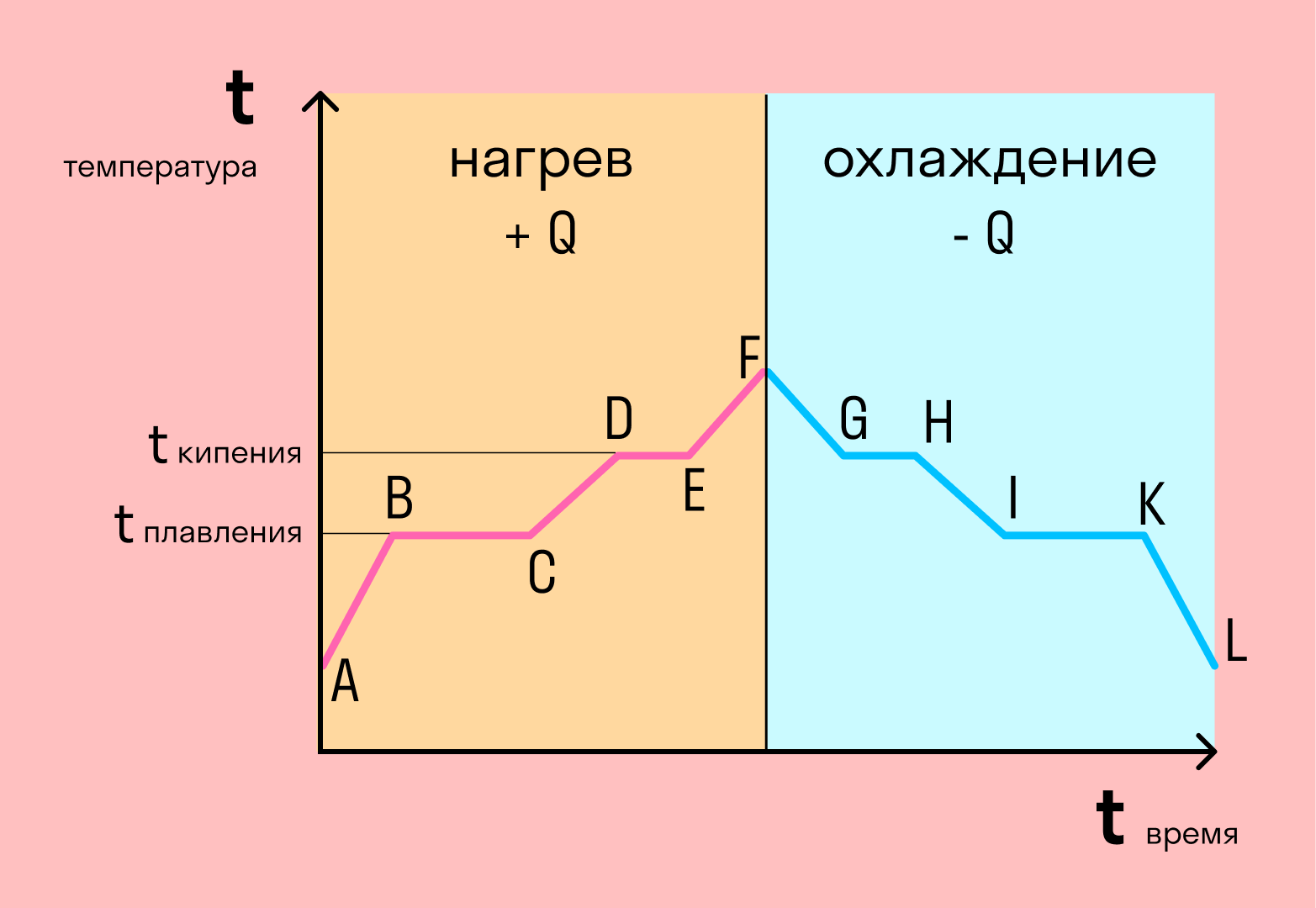
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни?
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.

Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Введение: агрегатное состояние вещества
Агрегатное состояние — состояние какого-либо вещества, имеющее определенные свойства: способность сохранять форму и объем, иметь дальний или ближний порядок и другие. При изменении агрегатного состояния вещества происходит изменение физических свойств, а также плотности, энтропии и свободной энергии.
Выделяют четыре типа агрегатных веществ:
Кажется, что химия открывает нам свои тайны в этих удивительных превращениях. Однако это не так. Переход из одного агрегатного состояния в другое, а также броуновское движение или диффузия относятся к физическим явлениям, поскольку в этих превращениях не происходит изменений молекул вещества и сохраняется их химический состав.
Газообразное состояние
На молекулярном уровне газ представляет собой хаотически движущиеся, сталкивающиеся со стенками сосуда и между собой молекулы, которые друг с другом практически не взаимодействуют. Поскольку молекулы газа между собой не связаны, то газ заполняет весь предоставленный ему объем, взаимодействуя и изменяя направление только при ударах друг о друга.
К сожалению, невооруженным глазом и даже с помощью светового микроскопа увидеть молекулы газа невозможно. Однако газ можно потрогать. Конечно, если вы просто попробуете ловить молекулы газов, летающие вокруг, в ладони, то у вас ничего не получится. Но наверняка все видели (или делали это сами), как кто-то накачивал воздухом шину автомобиля или велосипеда, и из мягкой и сморщенной она становилась накачанной и упругой. А кажущуюся «невесомость» газов опровергнет опыт, описанный на странице 39 учебника «Химия 7 класс» под редакцией О.С. Габриеляна.
Это происходит потому, что в замкнутый ограниченный объем шины попадает большое количество молекул, которым становится тесно, и они начинают чаще ударяться друг о друга и о стенки шины, а в результате суммарное воздействие миллионов молекул на стенки воспринимается нами как давление.
Но если газ занимает весь предоставленный ему объем, почему тогда он не улетает в космос и не распространяется по всей вселенной, заполняя межзвездное пространство? Значит, что-то все-таки удерживает и ограничивает газы атмосферой планеты?
Совершенно верно. И это — сила земного тяготения. Для того чтобы оторваться от планеты и улететь, молекулам нужно развить скорость, превышающую «скорость убегания» или вторую космическую скорость, а подавляющее большинство молекул движутся значительно медленнее.
Тогда возникает следующий вопрос: почему молекулы газов не падают на землю, а продолжают летать? Оказывается, благодаря солнечной энергии молекулы воздуха имеют солидный запас кинетической энергии, который позволяет им двигаться против сил земного притяжения.

Жидкое состояние
При повышении давления и/или снижении температуры газы можно перевести в жидкое состояние. Еще на заре ХIХ века английскому физику и химику Майклу Фарадею удалось перевести в жидкое состояние хлор и углекислый газ, сжимая их при очень низких температурах. Однако некоторые из газов не поддались ученым в то время, и, как оказалось, дело было не в недостаточном давлении, а в неспособности снизить температуру до необходимого минимума.
Жидкость, в отличие от газа, занимает определенный объем, однако она также принимает форму заполняемого сосуда ниже уровня поверхности. Наглядно жидкость можно представить как круглые бусины или крупу в банке. Молекулы жидкости находятся в тесном взаимодействии друг с другом, однако свободно перемещаются относительно друг друга.
Если на поверхности останется капля воды, через какое-то время она исчезнет. Но мы же помним, что благодаря закону сохранения массы-энергии, ничто не пропадает и не исчезает бесследно. Жидкость испарится, т.е. изменит свое агрегатное состояние на газообразное.
Испарение — это процесс преобразования агрегатного состояния вещества, при котором молекулы, чья кинетическая энергия превышает потенциальную энергию межмолекулярного взаимодействия, поднимаются с поверхности жидкости или твердого тела.
Испарение с поверхности твердых тел называется сублимацией или возгонкой. Наиболее простым способом наблюдать возгонку является использование нафталина для борьбы с молью. Если вы ощущаете запах жидкости или твердого тела, значит происходит испарение. Ведь нос как раз и улавливает ароматные молекулы вещества.
Жидкости окружают человека повсеместно. Свойства жидкостей также знакомы всем — это вязкость, текучесть. Когда заходит разговор о форме жидкости, то многие говорят, что жидкость не имеет определенной формы. Но так происходит только на Земле. Благодаря силе земного притяжения капля воды деформируется.
Однако многие видели как космонавты в условиях невесомости ловят водяные шарики разного размера. В условиях отсутствия гравитации жидкость принимает форму шара. А обеспечивает жидкости шарообразную форму сила поверхностного натяжения. Мыльные пузыри – отличный способ познакомиться с силой поверхностного натяжения на Земле.
Еще одно свойство жидкости — вязкость. Вязкость зависит от давления, химического состава и температуры. Большинство жидкостей подчиняются закону вязкости Ньютона, открытому в ХIХ веке. Однако есть ряд жидкостей с высокой вязкостью, которые при определенных условиях начинают вести себя как твердые тела и не подчиняются закону вязкости Ньютона. Такие растворы называются неньютоновскими жидкостями. Самый простой пример неньютоновской жидкости — взвесь крахмала в воде. Если воздействовать на неньютоновскую жидкость механическими усилиями, жидкость начнет принимать свойства твердых тел и вести себя как твердое тело.
Твёрдое состояние
Если у жидкости, в отличие от газа, молекулы движутся уже не хаотически, а вокруг определенных центров, то в твёрдом агрегатном состоянии вещества атомы и молекулы имеют четкую структуру и похожи на построенных солдат на параде. И благодаря кристаллической решетке твердые вещества занимают определенный объем и имеют постоянную форму.
Между твердыми и жидкими телами существует промежуточная группа аморфных веществ, представители которой с одной стороны за счет высокой вязкости долго сохраняют свою форму, а с другой – частицы в нем строго не упорядочены и находятся в особом конденсированном состоянии. К аморфным веществам относится целый ряд веществ: смола, стекло, янтарь, каучук, полиэтилен, поливинилхлорид, полимеры, сургуч, различные клеи, эбонит и пластмассы. Про аморфные тела подробно можно прочитать на странице 40 учебника «Химия 7 класс» под редакцией О.С. Габриеляна.
При определенных условиях вещества, находящиеся в агрегатном состоянии жидкости, могут переходить в твердое, а твердые тела, наоборот, при нагревании плавиться и переходить в жидкое.
Это происходит потому, что при нагревании увеличивается внутренняя энергия, соответственно молекулы начинают двигаться быстрее, а при достижении температуры плавления кристаллическая решетка начинает разрушаться и изменяется агрегатное состояние вещества. У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например – лед, чугун.
В зависимости от вида частиц, образующих кристаллическую решетку твердого тела, выделяют следующую структуру:
У одних веществ изменение агрегатных состояний происходит легко, как, например, у воды, для других веществ нужны особые условия (давление, температура). Но в современной физике ученые выделяют еще одно независимое состояние вещества — плазма.
Плазма — ионизированный газ с одинаковой плотностью как положительных, так и отрицательных зарядов. В живой природе плазма есть на солнце, или при вспышке молнии. Северное сияние и даже привычный нам костер, согревающий своим теплом во время вылазки на природу, также относится к плазме.
Искусственно созданная плазма добавляет яркости любому городу. Огни неоновой рекламы — это всего лишь низкотемпературная плазма в стеклянных трубках. Привычные нам лампы дневного света тоже заполнены плазмой.
Плазму делят на низкотемпературную — со степенью ионизации около 1% и температурой до 100 тысяч градусов, и высокотемпературную — ионизация около 100% и температурой в 100 млн градусов (именно в таком состоянии находится плазма в звездах).
Низкотемпературная плазма в привычных нам лампах дневного света широко применяется в быту.

Для проверки усвоения материала предлагаем небольшой тест.
1. Что не относится к агрегатным состояниям:
Агрегатные состояния вещества
Урок 6. Физика 7 класс ФГОС


В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности



Конспект урока «Агрегатные состояния вещества»
Агрегатные состояния вещества
Радость видеть и понимать –
есть величайший дар природы
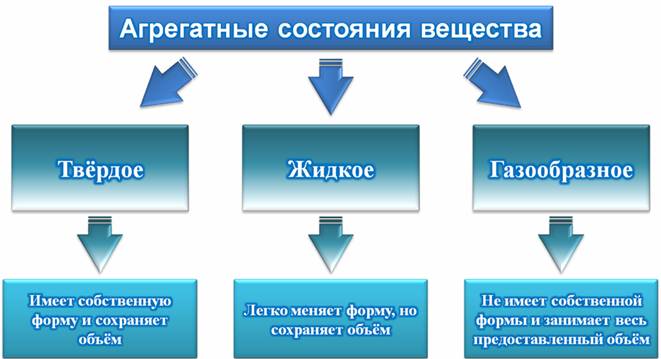
Данная тема посвящена изучению различных состояний вещества. Известно, что вода может находиться в трех состояниях: твердом, жидком и газообразном. То есть, при достаточно низких температурах вода становится льдом или снегом. И, наоборот, при достаточно высоких температурах, вода превращается в пар. Это, конечно, присуще не только воде, но и другим веществам. Итак, любое тело может быть твердым, жидким или газообразным. В зависимости от состояния, тела обладают различными свойствами. Известно, что твердые тела имеют собственную форму и сохраняет объём. Например, стол или стул – это твердые тела, поскольку они имеют определенную форму, которую сохраняют и занимают определенный объём. Для того чтобы изменить форму твердого тела, нужно приложить большое усилие. Например, практически невозможно согнуть или расплющить монету руками. Однако если по ней ударить молотком, то можно её расплющить. Другой пример: стеклянный стакан тоже сохраняет свой объем и форму. Конечно, стакан довольно легко разбить: чаще всего, достаточно просто уронить его на пол. Жидкости, напротив, легко меняют свою форму. Разумеется, это легко доказать, если переливать воду в емкости различной формы: вода будет принимать форму того сосуда, в который она помещена. Тем не менее, жидкости сохраняют свой объём. Это тоже легко проверить: если наполнить бутылку до краев водой и попробовать перелить эту воду в стакан, который явно поменьше. Можно убедиться, что вода туда не поместится: либо в бутылке останется немного воды, либо вода польётся через край стакана.
Газы не сохраняют ни форму, ни объём. Большинство газов прозрачны и бесцветны, а потому невидимы. Достаточно известен один пример газа – это воздух. Конечно, можно перемещаться по комнате, не испытывая никаких затруднений с дыханием. Значит, воздух заполняет всю комнату.
Если попробовать поднять стакан вверх дном и опустить его в воду, то вода его не заполнит. Почему? Потому что там воздух. Ранее был рассмотрен пример с воздушным шариком: можно без труда изменить объём и форму шарика, несмотря на то, что количество газа внутри шарика не меняется. Итак, газы не сохраняют ни свою форму, ни свой объём. Они принимают форму сосуда и заполняют весь предоставленный объём.
Одно и то же вещество может находиться в различных состояниях в зависимости от внешних условий (в основном, это температура).
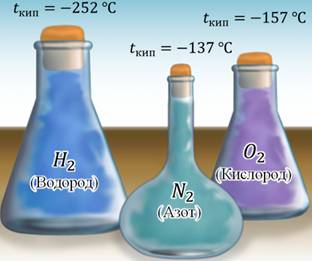
Например, водород закипает уже при температуре минус 252 градуса Цельсия (°С). Конечно, такую температуру на Земле можно получить только в лабораторных условиях и то, это довольно не просто. Газ азот (который является основной составляющей воздуха) становится жидким только при температуре минус 137°С, а кислород – при температуре минус 157°С. Поэтому, данные вещества практически всегда находятся в газообразном состоянии на нашей планете. Металлы – наоборот, почти всегда находятся в твердом состоянии. Дело в том, что для того, чтобы перевести их в жидкое состояние, нужны высокие температуры. Например, чтобы расплавить железо, нужно более полутора тысяч градусов Цельсия. Чтобы расплавить медь нужно нагреть её до температуры около тысячи ста градусов Цельсия. Такие температуры достигаются на различных заводах и фабриках, которые производят изделия из металлов.
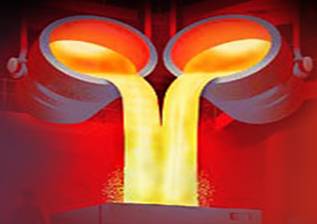
Люди используют свойство жидкости – легко менять свою форму. После того, как металлы переходят в жидкое состояние, их заливают в нужную форму, а потом остужают, чтобы они снова стали твердыми.
Изменение агрегатных состояний вещества постоянно происходит на нашей планете. Это отлично демонстрируется таким явлением, как круговорот воды в природе. Вода испаряется из водоемов, и водяные пары уносятся в атмосферу. Там они остывают, образуя облака и тучи. В конце концов, вода снова переходит в жидкое состояние и возвращается на Землю в виде осадков. Важно понимать, что изменение агрегатных состояний вещества не влечет за собой изменение молекул. Молекулы льда, воды и водяного пара абсолютно одинаковы: они состоят из двух атомов водорода и одного атома кислорода.
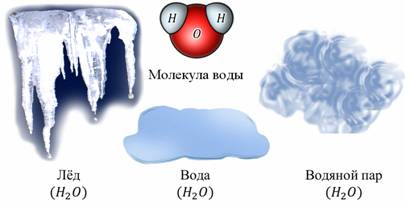
Поэтому, ни в коем случае нельзя путать изменение самого вещества с изменением его состояния. Различные агрегатные состояния вещества определяются расположением молекул, их движением и характером взаимодействия. Но об этом будет подробно рассказано в следующей теме.
– Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
– Твердые тела имеют собственный объём и сохраняют форму.
– Жидкости легко меняют форму, но при этом сохраняют объём.
– Газы не имеют своей формы и занимают весь предоставленный объём (то есть, не сохраняют ни объём, ни форму).
– Вещество переходит в то или иное агрегатное состояние в зависимости от внешних условий.
