Строение электронной оболочки атома
Атом состоит из ядра и электронной оболочки.
Электронная оболочка атома – это совокупность всех электронов в данном атоме.
Химические свойства элементов определяются строением электронных оболочек их атомов.
В 20-х годах ХХ в. ученые установили, что электрон имеет двойственную природу: он является одновременно частицей и волной (имеет свойства частицы и свойства волны).
Представление о двойственной природе электрона привело к созданию квантово-механической теории строения атома.
Согласно этой теории, электрон (как и другие микрочастицы) не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных частях атомного пространства.
Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна 90%), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Для характеристики орбиталей и электронов используются квантовые числа.
Энергия и размер орбитали и электронного облака характеризуются главным квантовым числом n.
Главное квантовое число принимает значения целых чисел от 1 до ∞(бесконечности): n = 1, 2, 3, 4, 5, 6, 7…∞
Орбитали, которые имеют одинаковое значение n, близки между собой по энергии и по размеру.
Совокупность орбиталей, которые имеют одинаковое значение главного квантового числа, — это энергетический уровень.
Энергетические уровни обозначаются большими буквами латинского алфавита.
Совокупность электронов, которые находятся на одном энергетическом уровне, — это электронный слой.
На одном энергетическом уровне могут находиться орбитали (электронные облака), которые имеют различные геометрические формы.
Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l.
Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число принимает значения целых чисел от 0 до n-1.
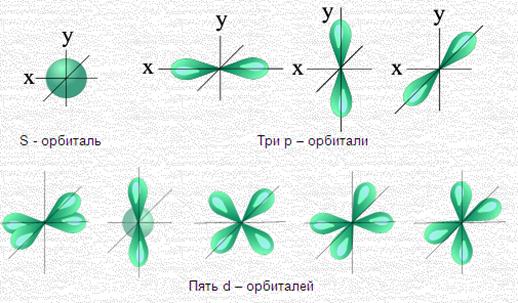
Орбитали, для которых l = 0, имеют форму шара (сферы) и называются s-opбиталями (условно изображаются в виде окружности):
s –орбитали имеются на всех энергетических уровнях.
На K-уровне (на первом энергетическом уровне) имеется только s-орбиталь.
Орбитали, для которых l=1, имеют форму гантели и называются р-орбиталями:
р-Орбитали имеются на всех энергетических уровнях, кроме первого (K) уровня.
Орбитали с большими значениями l имеют более сложную форму и обозначаются так:
l = 2: d-орбитали;
l = 3: f-орбитали.
d-Орбитали есть на всех энергетических уровнях, кроме первого (K) и второго (L) уровней.
f-Oрбитали есть на всех энергетических уровнях, кроме первого (K), второго (L) и третьего (М) уровней.
Энергия орбиталей (Е), которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова:
Итак, каждая орбиталь и электрон, который находится на этой орбитали, характеризуются тремя квантовыми числами: главным n, побочным l и магнитным m1.
Электрон характеризуется еще одним — спиновым квантовым числом (от англ. to spin — кружить, вращать).
Спиновое квантовое число (спин электрона) ms, характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и – 1/2.
Схематично это можно показать так:
Электрон со спином +1/2 — условно изображают так: ↑; со спином —1/2: ↓
Принцип Паули гласит:
В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Поэтому на одной орбитали не может быть больше двух электронов; эти два электрона имеют одинаковый набор трех квантовых чисел (n, l, m1) и должны отличаться спинами (спиновым квантовым числом ms:

Два электрона, которые находятся на одной орбитали, называются спаренными (или неподеленной электронной парой). Спаренные электроны являются электронами с противоположными (антипараллельными) спинами.
 didi79
didi79
Я Леди.
2.4 Электронные орбитали и их энергия
ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g.
Названия первых трех сложились исторически, далее был выбран алфавитный принцип. Формы орбиталей вычислены методами квантовой химии.
Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
p- орбиталь – орбиталь гантель
d- орбиталь – орбиталь сложной формы
Квантовые числа электронов
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел:
Принципы заполнения орбиталей
1. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами) (принцип Паули).
2. В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной.
Энергия орбиталей возрастает в ряду:
1S Полная электронная формула элемента
Запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной конфигурацией этого атома. В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии. Это значит, что сначала заполняются подуровни, для которых:
1. Число n минимально
2. Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d- (l минимально)
3. Один подуровень содержит наибольшее число неспаренных электронов.
4. При заполнении электронных атомных орбиталей выполняется принцип Паули. Его следствием является, что энергетическому уровню с номером n может принадлежать не более чем 2n2 электронов, расположенных на n2 подуровнях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
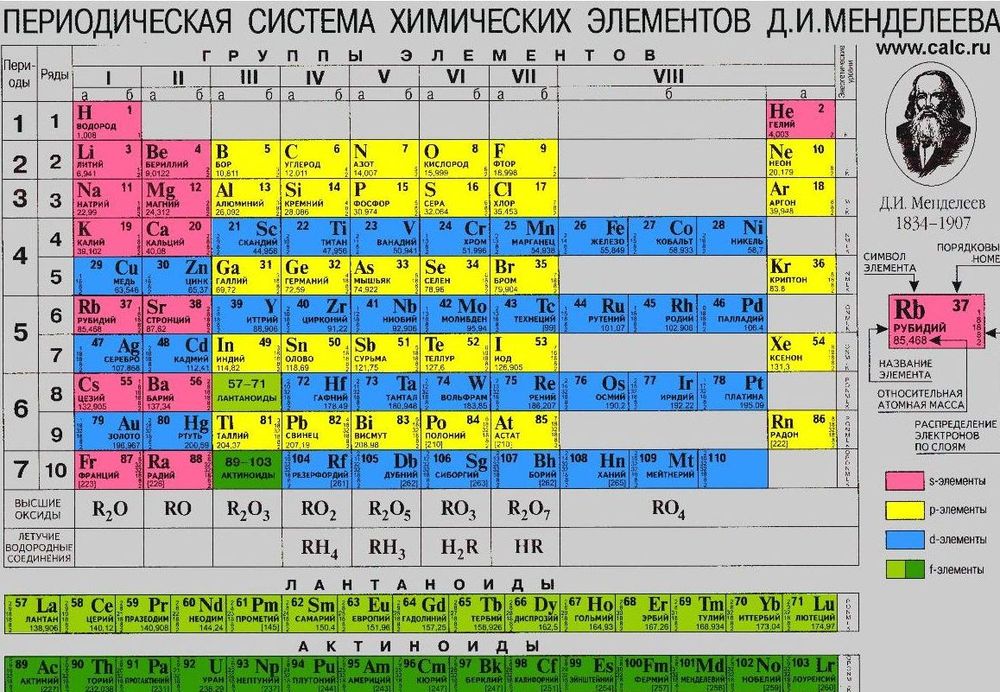
Химические свойства элемента определяются электронами самого последнего (наиболее удаленного от ядра) заселенного уровня.
Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p-, d-элементы
Содержание:
Тема строения атома – это место встречи химии и квантовой физики. В атоме всё подчиняется строгим законам, но в то же время атом не совсем понятен для человеческого ума. Например, количество электронов строго равно количеству протонов, но невозможно точно сказать, в каком месте атома находится электрон. Шрёдингер рассматривал электрон как облако с отрицательным зарядом. Большинство своего времени электрон в отдельном участке атома – орбитали.
Все электроны в атоме расположены на своём расстоянии от ядра – в электронной оболочке. Электрон не может приблизиться к ядру, но и отдалиться тоже не может. Дело в том, что у электрона есть свой запас энергии. Чем её меньше, тем ближе от ядра располагается электрон. Электроны с одинаковым уровнем энергии группируются в один слой – энергетический уровень.
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
| Номер уровня (n) и его буквенное обозначение | Количество подуровней | Максимальное количество электронов на уровне |
| 1 К | 1 (s) | 2 |
| 2 L | 2 (s, p) | 8 |
| 3 M | 3 (s, p, d) | 18 |
| 4 N | 4 (s, p, d, f) | 32 |
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.

Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:

На первом энергетическом уровне есть только сферическая s-орбиталь. На втором энергетическом уровне появляются три p-орбитали. Их форма напоминает гантель или восьмёрку. На третьем энергетическом уровне уже есть пять d-орбиталей, которые как бы состоят из нескольких лепестков. На четвёртом уровне возникают семь f-орбиталей.
Форму орбиталей обозначают орбитальным (побочным) квантовым числом l (эль). Оно на единицу меньше главного квантового числа, то есть l = n – 1. Тогда получается, что орбитальное число единственной s-орбитали первого энергетического уровня равно нулю. Орбиталь p имеет число 1, орбиталь d – 2, f – 3.
Но как же располагаются орбитали внутри одного подуровня? Дело в том, что движущийся электрон создаёт магнитное поле, в котором по осям x, y, z ориентируются орбитали.
Сферическая s-орбиталь не имеет ориентации в пространстве. Три p-орбитали располагаются в трёх различных проекциях, d – в пяти, f – в семи проекциях. Другими словами, сколько орбиталей одного типа, столько и проекций.
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.

Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
Квантовые числа
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Электроны заполняют орбитали в соответствии с 3 принципами (правилами).
Новое в блогах
Орбитальный конфуз
Пространственной модели атома не существует. Имеются лишь пространственные характеристики орбиталей, изображаемых раздельно. Казалось бы, что мешает соединить разные орбитали в целостный атом?
Но нет, не получается.
Все химические элементы первой и второй группы согласно принятой таблице Менделеева имеют внешние оболочки в форме сферических s-орбиталей. Получается, что по внешним оболочкам они ни чем не отличаются от гелия, все эти атомы окружают сферические орбитали. Но по химическим свойствам эти элементы отличаются от гелия, причем радикально.
Становится понятным, почему химики не могут изобразить картинку атома целиком – все «дубинки» будут торчать из центра, пучками, накладываясь друг на друга, а их же десятки.
Интересно, почему профессионалы-химики не видят несуразности предложенных орбиталей?
Имеет ли реальный атом что-либо похожее на абракадабру, сконструированную из вычисленных орбиталей? Конечно, нет. Расчет орбиталей, производимый по уравнению Шрёдингера, изначально обречен на «сомнительный» результат. Расчет же ведется из предположений:
— что электроны движутся вокруг ядра, а они в атоме не движутся
— что электроны находятся в центрально-радиальном поле, а оно не является таковым
— что атомы водородоподобные (что один электрон), а их много
— что электроны не взаимодействуют между собой, а они взаимодействуют.
Думаю, реальную модель атома можно построить лишь после выяснения строения электронов. А его пока нет.
Скрытая от нас красота
Каждому свое красиво.
Цицерон
Кто такие «мы» и что от нас скрывают? Речь пойдет о химиках, впрочем, это касается всех. В нашем путешествии потребуется путеводитель, или карта местности, чтобы быстрее достичь скрытой цели. Такой путеводитель у химика всегда под рукой – это таблица Менделеева. Дальнейший рассказ станет гораздо интереснее, если эта таблица будет у вас под руками.
Представьте себе, что вы познакомились с интересным человеком, от которого постоянно узнаете необычные и занимательные сведения. Сначала будет вполне достаточно получать интересную информацию, но постепенно вас заинтересует и сам этот человек. Захочется узнать его вкусы, взгляды, привязанности, как он живет.
В нашей статье информацию предоставляют электроны. Именно они (в первую очередь валентные электроны) определяют поведение веществ, образованных химическими элементами, бесконечное разнообразие их химических превращений. Рассмотрим, в каких условиях живут электроны. Нельзя сказать, что архитектуру их жилища от нас кто-то скрывает, но истинная картина мало кому знакома.
Природа – превосходный дизайнер
Напомним, что область пространства, которую занимает электрон в атоме или молекуле, называют орбиталью. Привычным и даже популярным стало не только само понятие орбиталей, но и их внешний облик, который иногда можно увидеть на обложках книг. Например, на обложке одного из школьных учебников химии изображена схема молекулы воды, похожий сюжет – схема молекулы метана (рис. 1).
Рис. 1.
Популярность и изящество орбиталей
Обе конструкции очень привлекательны. Расположенные внутри тетраэдра орбитали, напоминающие удлиненные надувные шары, соприкасаются с орбиталями-сферами.
В молекуле метана – орбитали молекулярные, мы же сосредоточим внимание на более простых объектах – атомных орбиталях. Где же располагаются электроны в изолированных атомах, не связанных химическими связями? Полюбовавшись показанными картинками, отложим в сторону эмоции и внесем грустную ноту – истинные молекулярные орбитали в метане внешне довольно заметно отличаются от того, что изображено на большинстве картинок. О том, почему такое произошло, поговорим несколько позже.
Каковы они на самом деле?
Итак, электрон движется в атоме вокруг ядра не по фиксированной линии – орбите, а занимает некоторую область пространства. Ранее использовали термин «орбита», но постепенно пришли к мысли, что орбита (от лат. orbita – колея) – это линия в пространстве. Например, по земной орбите движется наша планета вокруг Солнца. Область нахождения электрона – не линия, а некая объемная часть пространства, поэтому стали применять термин «орбиталь». Своеобразие понятия «орбиталь» состоит в том, что эта часть пространства не имеет четких границ, она размыта. Например, электрон в атоме водорода (рис. 2а) может с определенной вероятностью оказаться либо весьма близко к ядру, либо на значительном удалении (точки, обозначающие случайное местонахождение электрона, в некоторой определенной области располагаются гуще).
Существует область пространства, где нахождение электрона наиболее вероятно. В целях наглядности орбиталь ограничивают поверхностью, очерчивающей область пространства, где вероятность появления электрона наибольшая, иначе говоря, где электронная плотность максимальна (рис. 2б). Итак, орбиталь следует воспринимать как некое объемное тело, внутри которого электрон находится с вероятностью 95%.
Рис. 2.
Случайное положение электрона
в районе атомного ядра (а)
и способ изображения той области,
где находится электрон (б)
У атома водорода орбиталь электрона имеет сферическую (шаровую) форму, следовательно, электронная плотность в направлении каждой оси трехмерных координат одинакова (рис. 3). Это так называемая s-орбиталь.
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип, таким образом, никакого скрытого смысла эти буквы не несут. Орбитали существуют независимо от того, находятся на них электроны (занятые орбитали) или отсутствуют (вакантные орбитали). Интересно, что атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех энергетических уровнях, а их заполнение электронами происходит по мере увеличения порядкового номера элемента, т.е. заряда ядра атома.
 | |||||||||||
 | ||||||||||
 | |||||||||
 | ||||||||
 | |||||||
 | ||||||
 | |||||
 | ||||
 | |||
 | ||
 | |
 |
 |

 Все это, а также различные, более серьезные беседы, которые помогут развить фантазию, раскрепостить воображение, научат находить нестандартные решения задач, приведены в книге М.М. Левицкого «О химии серьезно и с улыбкой» (эту книгу можно заказать в издательстве «Академкнига» через агентство «Почта-Сервис»: 125413, г. Москва, а/я 5, тел. (495) 453-60-13, e-mail: agentstvops@list.ru). Из нее вы узнаете, что в химии можно с помощью цепочек рассуждений обнаружить неизвестные ранее соединения или предсказать структуры новых молекул.
Все это, а также различные, более серьезные беседы, которые помогут развить фантазию, раскрепостить воображение, научат находить нестандартные решения задач, приведены в книге М.М. Левицкого «О химии серьезно и с улыбкой» (эту книгу можно заказать в издательстве «Академкнига» через агентство «Почта-Сервис»: 125413, г. Москва, а/я 5, тел. (495) 453-60-13, e-mail: agentstvops@list.ru). Из нее вы узнаете, что в химии можно с помощью цепочек рассуждений обнаружить неизвестные ранее соединения или предсказать структуры новых молекул.